题目内容
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
【答案】15.4% 8 94.1 6.8 1:2 1.2
【解析】
(1)根据体积分数的定义解析;
(2)列出三段式,用![]() 求出反应的二氧化硫;
求出反应的二氧化硫;
(3)根据反应前后的氧气差,求出应加入和空气的量,再根据速率比等于物质的量之比求角;
(4)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0.浓硫酸增加的质量就是氨气的质量.第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量.利用第二次的量计算(因为是OH-不足)。
(1)设1mol空气中N2、O2的分别为0.8mol和0.2mol,由4FeS2+11O2![]() 2Fe2O3+8SO2 ,0.2molO2可获得SO2为
2Fe2O3+8SO2 ,0.2molO2可获得SO2为![]() ,所得气体中SO2的体积分数不超过
,所得气体中SO2的体积分数不超过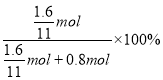 =15.4%(保留一位小数)。
=15.4%(保留一位小数)。
故答案为:15.4%;
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则:
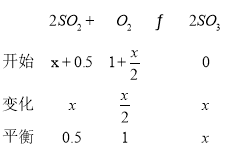
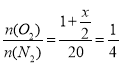 ,x=8,此时反应中SO2的转化率为
,x=8,此时反应中SO2的转化率为![]() =94.1%(保留一位小数)。
=94.1%(保留一位小数)。
故答案为:8;94.1;
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则通入的空气中的氧气为8×4-1=31,空气为31×5=155,![]() 则再往接触室里通入的空气的流速应为v=6.8m3/s(保留一位小数;气体体积在同温同压下测定)。
则再往接触室里通入的空气的流速应为v=6.8m3/s(保留一位小数;气体体积在同温同压下测定)。
故答案为:6.8;
(4)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0,浓硫酸增加的质量就是氨气的质量,第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量,利用第二次的量计算(因为是OH-不足)。
设:(NH4)2SO3的物质的量为a,NH4HSO3的物质的量为b,
116a+99b=3.140(质量守恒)…①
17(2a+b)=0.680(元素守恒)…②
解得a=0.010mol,b=0.020mol,即(NH4)2SO3和NH4HSO3的物质的量之比为1:2;
再根据(NH4)2SO3~2NaOH,NH4HSO3~NaOH,可算出x=1.2mol·L-1.
故答案为:1:2;1.2。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) ![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的ΔH=_______。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

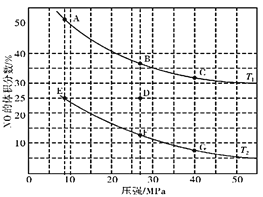
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
②X轴上a点的数值比b点________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_____________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为__________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_________;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq) ![]() PbI2(s)+2Cl-(aq)的平衡常数K=_________。
PbI2(s)+2Cl-(aq)的平衡常数K=_________。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) =2HI(g) 的ΔH__________(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是________、_________(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________。
I3-,图2中曲线a、b分别代表的微粒是________、_________(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________。
【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。