题目内容
【题目】按要求计算并填空
(1)32gSO2标况下的体积为____________L,含有______________个氧原子。
(2)1.204×1023个NH3分子所含的氢原子数与________mol CH4含有的氢原子数相同。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,则混合气体中CO2和H2的体积比约为______________。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为________mol/L。
(5)把VmL含有Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a mol NH3(已知NH4++OH-![]() NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
(6)将20.0g质量分数为14.0%的 NaNO3溶液与30.0g质量分数为24.0%的NaNO3溶液混合,得到的密度为1.15g/cm3的混合溶液。混合后溶液的物质的量浓度为______(结果保留1位小数)。
【答案】11.2 6.02×1023或NA 0.15 13:8 2.5 ![]() 2.7mol/L
2.7mol/L
【解析】
(1)32gSO2标况下的体积为![]() 11.2L,含有氧原子数
11.2L,含有氧原子数![]() NA。
NA。
(2)1.204×1023个NH3分子的物质的量是![]() , 所含的氢原子数的物质的量是0.6mol,含有的氢原子数相同的CH4的物质的量是
, 所含的氢原子数的物质的量是0.6mol,含有的氢原子数相同的CH4的物质的量是![]() 0.15mol 。
0.15mol 。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,混合气体的平均摩尔质量是1.25g/L×22.4L/mol=28g/mol,设CO2和H2的物质的量分别是xmol、ymol,![]() ,
,![]() ,则混合气体中CO2和H2的体积比约为13:8。
,则混合气体中CO2和H2的体积比约为13:8。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则SO42- 、金属离子的物质的量分别是1.5mol、1mol,该盐的化学式可表示为R2(SO4)3,该硫酸盐的物质的量是0.5mol,则该硫酸盐溶液的物质的量浓度为![]() =2.5mol/L。
=2.5mol/L。
(5)一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,说明硫酸根离子的物质的量为bmol;一份加入足量NaOH的溶液并加热,生成amol NH3,则(NH4)2SO4的物质的量是![]() mol ;则Al2(SO4)3的物质的量是
mol ;则Al2(SO4)3的物质的量是![]() mol,Al3+的物质的量是
mol,Al3+的物质的量是![]() mol,原混合溶液中Al3+的浓度为
mol,原混合溶液中Al3+的浓度为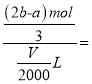
![]() mol/L。
mol/L。
(6)混合后溶质的物质的量是![]() ,混合后溶液的体积是
,混合后溶液的体积是![]() ,物质的量浓度为0.118mol÷0.043L=2.7mol/L。
,物质的量浓度为0.118mol÷0.043L=2.7mol/L。

 阅读快车系列答案
阅读快车系列答案