题目内容
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。
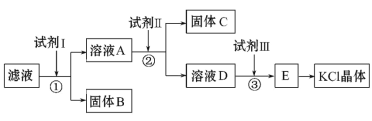
回答下列问题:
(1)试剂Ⅰ的化学式为_______,
(2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。
(3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。
【答案】BaCl2 K2CO3 加入碳酸钾的目的是除去多余的Ba2+ 盐酸 2HCl+K2CO3=2KCl+CO2↑+H2O
【解析】
提纯氯化钾,除去SO42-、CO32-需要加入过量的BaCl2,过量的BaCl2需要加入碳酸钾除去,过量的K2CO3需要加入盐酸,据此分析;
提纯氯化钾,氯化钾中含有的杂质是K2CO3、K2SO4,除去SO42-、CO32-需要加入BaCl2溶液,即试剂①为BaCl2,得到BaSO4、BaCO3沉淀和KCl、BaCl2滤液,然后过滤,用K2CO3除去过量的BaCl2,试剂Ⅱ为K2CO3,然后为过滤,溶液D含有过量的K2CO3,需要加入HCl除去,试剂Ⅲ为盐酸,E为KCl和HCl混合液,然后蒸发结晶,得到KCl晶体;
(1)根据上述分析,试剂I为BaCl2溶液;
答案为BaCl2溶液;
(2)试剂Ⅱ为K2CO3,加入碳酸钾的目的是除去多余的Ba2+;
答案为K2CO3;加入碳酸钾的目的是除去多余的Ba2+;
(3)试剂Ⅲ为盐酸,发生的反应为2HCl+K2CO3=2KCl+CO2↑+H2O;
答案为盐酸;2HCl+K2CO3=2KCl+CO2↑+H2O。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表,下列说法不正确的是
M(g)+N(g),所得实验数据如下表,下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 900 | 0.10 | 0.15 | a |
A. 正反应为放热反应
B. 实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速率v(N)= 0.01mol/(Lmin)
C. 实验②中,该反应的平衡常数K=1.0
D. 实验③中,达到平衡时,a大于0.06