题目内容
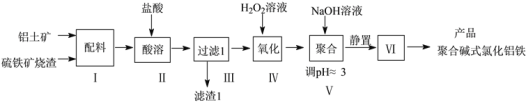
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
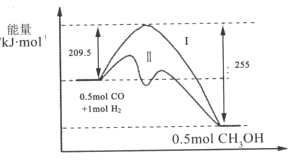
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
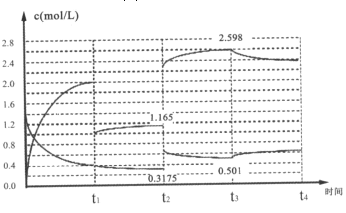
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
【答案】CO(g)+2H2(g)CH3OH(g)△H=-91kJ/mol 10% 增大CO浓度;适当降低温度(或及时分离生成的CH3OH) BD 增大压强 10
【解析】
Ⅰ、(1)图象分析可知反应生成0.5mol甲醇的焓变△H=209.5kJ/mol-255 kJ /mol=--45.5 kJ /mol,反应CO(g)+2H2(g)CH3OH(g)的焓变△H=-91 kJ /mol,标注物质聚集状态和对应反应的焓变写出反应的热化学方程式;
(2)转化率=参加反应的CO的物质的量与最初CO的物质的量之比;
(3)要提高H2的转化率,可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法;
(4)催化剂对可逆反应的影响是降低反应的活化能,几块反应速率,不改变化学平衡;
Ⅱ、(5)图象分析可知,t2时刻改变条件氮气浓度增大,氨气浓度增大,随后氨气浓度增大,氮气浓度减小说明是改变的压强,平衡正向进行;
(6)t2时刻平衡常数和t3平衡常数不变,平衡常数K=![]() ;
;
Ⅰ、(1)图象分析可知反应生成0.5mol甲醇的焓变△H=209.5 kJ /mol-255 kJ /mol=--45.5 kJ /mol,反应CO(g)+2H2(g)CH3OH(g)的焓变△H=-91 kJ /mol,标注物质聚集状态和对应反应的焓变写出反应的热化学方程式为:CO(g)+2H2(g)CH3OH(g)△H=-91 kJ /mol,
故答案为:CO(g)+2H2(g)CH3OH(g)△H=-91 kJ /mol;
(2)若按上述投料比使该反应具有工业应用价值,根据方程式知,参加反应的一氧化碳和生成的甲醇的物质的量相等,所以CO的平衡转化率为:![]() ×100%=10%,
×100%=10%,
故答案为:10%;
(3)可以采取增大CO浓度、适当降低温度、及时分离生成的CH3OH的方法来促使平衡向正反应方向移动,从而提高氢气的转化率,
故答案为:增大CO浓度;适当降低温度(或及时分离生成的CH3OH);
(4)使用催化剂,只能改变反应速率,不能改变化学平衡,则不会改变反应的焓变、不会影响反应物转化率、不影响化学平衡常数,
A.反应历程Ⅱ和反应历程Ⅰ放出的热量相同,故A错误;
B.反应历程Ⅱ降低了反应的活化能,反应速率比反应历程Ⅰ反应速率快,故B正确;
C.反应历程Ⅱ比反应历程Ⅰ温度不变,平衡常数不变,故C错误;
D.反应历程Ⅱ和反应历程Ⅰ反应速率不同,达到相同平衡状态,反应中CO转化率相同,故D正确;
故答案为:BD;
Ⅱ、(5)图象分析可知,t2时刻改变条件氮气浓度增大,氨气浓度增大,随后氨气浓度增大,氮气浓度减小说明是改变的压强,平衡正向进行,t2改变的条件是增大压强,
故答案为:增大压强;
(6)t2时刻平衡常数和t3平衡常数不变,c(N2)=0.3175mol/L,t1时刻分离氨气1mol/L,平衡状态c(NH3)=1.165mol/L,c(H2)=4mol/L-2×1.165mol/L=0.7525mol/L
平衡常数K=![]() ≈10,
≈10,
故答案为:10。