题目内容
14.己知红磷转化为白磷需要吸收热量.①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H1<△H2 | D. | 无法确定 |
分析 根据①-②可得到4P(s,红)=4P(s,白)△H=△H1-△H2,结合红磷转化为白磷时需吸收热量来解答.
解答 解:①4P(s,红)+502(g)═2P205(s)△H1,②4P(s,白)+502(g)═2P205(s)△H2,
由①-②可得到4P(s,红)=4P(s,白)△H=△H1-△H2,因红磷转化为白磷时需吸收热量,则△H=△H1-△H2>0,所以△H1>△H2,
故选B.
点评 本题考查反应热的比较,明确盖斯定律的应用及物质的能量与稳定性的关系即可解答,题目难度不大.

练习册系列答案
相关题目
4.某铝热剂由铁红和铝组成.取a g该铝热剂样品,向其中加入足量的NaOH溶液,测得生成气体的体积为V1 L(标准状况,下同).
另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
| A. | 3:2 | B. | 4:3 | C. | 1:1 | D. | 8:9 |
5.常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反应,产生CO2的体积( )
| A. | 同样多 | B. | HCl最多 | C. | HCl、HNO3一样多 | D. | CH3COOH最少 |
2.已知aA+、b${\;}^{{B}^{2+}}$、c${\;}^{{C}^{-}}$、d${\;}^{{D}^{2-}}$具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
19.下列离子方程式书写正确的是( )
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
20.设NA为阿伏加德罗常数,则下列说法正确的是( )
| A. | 1mol羟基与17g NH3所含电子数都为10NA | |
| B. | 1molCl2溶于水的过程中有NA个电子转移 | |
| C. | 1molC(金刚石)中σ 键的数目为2NA | |
| D. | 适量铜粉溶解于1L 0.5 mol/L稀硝酸中,当生成2.24L NO时,溶液中氮原子数为0.4NA |
1.一般来说,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质.下列关于同主族元素所形成的物质的性质推理中,正确的是( )
| A. | Na 与 Cl2反应能形成离子键,故 K与 Cl2反应也能形成离子键 | |
| B. | Cl2 能置换出 NaBr溶液中的溴,故I2也能置换出NaBr溶液中的溴 | |
| C. | Li在氧气中燃烧生成 Li2O,故Na在氧气中燃烧也生成Na20 | |
| D. | C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在 |
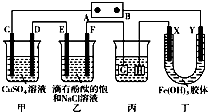 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题:
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答下列问题: