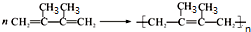题目内容
5.常温下,体积相同、pH也相同的HCl、HNO3、CH3COOH溶液分别与足量的NaHCO3溶液反应,产生CO2的体积( )| A. | 同样多 | B. | HCl最多 | C. | HCl、HNO3一样多 | D. | CH3COOH最少 |
分析 HCl、HNO3为强酸,体积、pH相同时,c(H+)相同;而CH3COOH为弱酸,其c(CH3COOH)>c(H+),c(H+)越大,与足量NaHCO3反应产生CO2的体积就越大.
解答 解:因HCl、HNO3为强酸,CH3COOH为弱酸,
体积相同、pH也相同的HCl、HNO3、CH3COOH溶液中,HCl、HNO3中c(H+)相同,且都小于c(CH3COOH),
醋酸在反应中可继续电离产生H+,最终电离生成的c(H+)最大,
则与足量NaHCO3反应产生CO2的体积最大,
即产生气体的体积关系为:V(CH3COOH)>V(HCl)=V(HNO3),
故选C.
点评 本题考查弱电解质的电离平衡及其应用,题目难度中等,明确酸的酸性强弱及溶液中氢离子的浓度与pH的关系是解答本题的关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列变化过程中,只破坏共价键的是( )
| A. | HCl溶于水得盐酸 | B. | NaCl颗粒被粉碎 | ||
| C. | I2升华 | D. | NH4Cl晶体加热分解 |
16.在一定温度下,不能做为反应A2(g)+B2(g)?2AB(g)达到平衡的判断标志是( )
| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
20.下列关于有机物存在的叙述中,错误的是( )
| A. | 工业酒精中含有乙醇和甲醇 | B. | 在煤炭和石油中,苯的含量都较高 | ||
| C. | 许多水果中含有酯类化合物 | D. | 天然油脂中含有高级脂肪酸甘油酯 |
10.下列电化学有关说法中正确的是( )
| A. | 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率 | |
| B. | 镀锌铁制品镀层受损后,铁制品仍不易生锈 | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 纯银在空气中久置变黑发生的是电化学腐蚀 |
14.己知红磷转化为白磷需要吸收热量.
①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H1<△H2 | D. | 无法确定 |
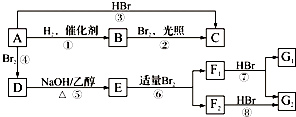
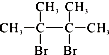 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答: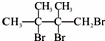 .
.