题目内容
4.某铝热剂由铁红和铝组成.取a g该铝热剂样品,向其中加入足量的NaOH溶液,测得生成气体的体积为V1 L(标准状况,下同).另取a g该样品将其引燃,恰好完全反应,待反应产物冷却后,加入足量稀盐酸,测得生成气体的体积为V2 L.若不考虑空气中O2的影响,则V1:V2为( )
| A. | 3:2 | B. | 4:3 | C. | 1:1 | D. | 8:9 |
分析 铝热剂中只有Al和氢氧化钠反应,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝热剂发生反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,反应后的物质中只有Fe和稀盐酸反应生成氢气,根据铝热反应知,Al和Fe的物质的量之比为1:1,根据转移电子计算生成气体体积之比.
解答 解:铝热剂中只有Al和氢氧化钠反应,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝热剂发生反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,反应后的物质中只有Fe和稀盐酸反应生成氢气,根据铝热反应知,Al和Fe的物质的量之比为1:1,假设Al、Fe的物质的量都是2mol,2molAl在反应中转移6mol电子、2molFe在反应中转移4mol电子,所以2molAl和NaOH完全反应生成3mol氢气、2molFe和稀盐酸反应生成2mol氢气,根据V=nVm知,相同条件下生成氢气体积之比等于氢气的物质的量之比=3mol:2mol=3:2,故选A.
点评 本题考查混合物的计算,侧重考查学生分析计算能力,利用转移电子进行计算能化繁为简,提高解题效率,还可以根据方程式进行计算,题目难度不大.

练习册系列答案
相关题目
14.下列说法中正确的是( )
| A. | 乙醛与新制Cu(OH)2悬浊液反应生成红色的Cu2O沉淀 | |
| B. | 银镜反应中醛发生的是还原反应 | |
| C. | 甲醛、乙醛、丙醛都没有同分异构体 | |
| D. | 醛类催化加氢后都能得到饱和一元醇 |
15.下列变化过程中,只破坏共价键的是( )
| A. | HCl溶于水得盐酸 | B. | NaCl颗粒被粉碎 | ||
| C. | I2升华 | D. | NH4Cl晶体加热分解 |
19.某元素X的气态氢化物化学式为XH3,则X的最高价氧化物的水化物及相应的酸性氧化物化学式均正确的是( )
| A. | HXO3 XO2 | B. | HXO2 X2O3 | C. | H3XO3 X2O3 | D. | H3XO4 X2O5 |
9.在强酸性或强碱性溶液中都能大量共存的一组离子是( )
| A. | Ba2+、Fe3+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、NH4+、SO42-、Na+ | D. | Na+、K+、NO3-、SO42- |
16.在一定温度下,不能做为反应A2(g)+B2(g)?2AB(g)达到平衡的判断标志是( )
| A. | 单位时间内生成n mol A2的同时消耗n mol A2 | |
| B. | 容器内的各组分的浓度不随时间变化而变化 | |
| C. | 单位时间内生成2n mol AB的同时生成n mol B2 | |
| D. | A2、B2和AB的分子数之比为1:1:2 |
14.己知红磷转化为白磷需要吸收热量.
①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H1<△H2 | D. | 无法确定 |
 .
.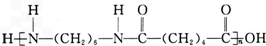 +(2n-1)H2O.
+(2n-1)H2O.