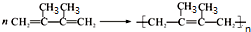题目内容
2.已知aA+、b${\;}^{{B}^{2+}}$、c${\;}^{{C}^{-}}$、d${\;}^{{D}^{2-}}$具有相同的电子层结构,有关A、B、C、D四种元素的叙述中正确的是( )| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
分析 aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,原子序数:b>a>c>d,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期,由电荷可知,A、B为金属元素,C、D为非金属性元素.
同周期自左而右原子半径减小、同主族自上而下原子半径增大,同周期自左而右金属性减弱、非金属性增强,电子层结构相同的离子,核电荷数越大离子半径越小.
解答 解:aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,故原子序数:b>a>c>d,且A与B同周期,C与D同周期,A、B在周期表中C、D的下一周期.
A.aA+、bB2+、cC-、dD2-四种离子均具有相同的电子层结构,则有:a-1=b-2=c+1=d+2,故原子序数:b>a>c>d,故A正确;
B.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:A>B>D>C,故B错误;
C.由电荷可知,A、B为金属元素,C、D为非金属性元素,同周期自左而右金属性减弱、非金属性增强,故金属性:A>B,非金属性:C>D,故C错误;
D.核电荷数:D<C<A<B,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:D>C>A>B,故D错误,
故选A.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
10.下列电化学有关说法中正确的是( )
| A. | 将钢闸门与直流电源的正极相连,可降低钢闸门腐蚀速率 | |
| B. | 镀锌铁制品镀层受损后,铁制品仍不易生锈 | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 纯银在空气中久置变黑发生的是电化学腐蚀 |
7.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 若5.6LN2中含有n个氮分子,则阿伏加德罗常数一定为4n | |
| B. | 4.6gNa与100 mL含0.1mol HCl的盐酸溶液反应,转移电子数目为0.2NA | |
| C. | 14g乙烯和丙烯的混合气体中所含分子总数为0.5NA | |
| D. | 标准状况下,22.4LCCl4含有的分子总数为NA |
14.己知红磷转化为白磷需要吸收热量.
①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
①4P(s,红)+502(g)═2P205(s)△H1
②4P(s,白)+502(g)═2P205(s)△H2
则△H1与△H2的关系正确的是( )
| A. | △H1=△H2 | B. | △H1>△H2 | C. | △H1<△H2 | D. | 无法确定 |
8.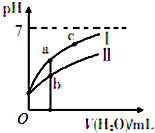 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
(1)图象中,曲线Ⅰ表示的酸是CH3COOH(填化学式);起始时,c(CH3COOH)<c(HClO)
(填“>”、“<”、“=”).
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=$\frac{1}{3}$×10-6mol•L-1.
(4)向NaClO溶液中通入少量CO2的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
 已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.
已知下表为25℃时某些弱酸的电离平衡常数;如图表示常温时,稀释CH3COOH、HC1O两种酸的稀溶液时,溶液pH随加水量的变化.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | K$_{{a}_{1}}$a1=4.4×10-7K$_{{a}_{2}}$a2=4.7×10-11 |
(填“>”、“<”、“=”).
(2)a、b、c三点中,水的电离程度由大到小的顺序是c>a>b(用编号表示).
(3)25℃时,NaClO溶液的水解平衡常数Kh=$\frac{1}{3}$×10-6mol•L-1.
(4)向NaClO溶液中通入少量CO2的离子方程式为ClO-+CO2+H2O═HClO+HCO3-.
9.NA代表阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 标准状况下,2.24LC6H14中含有1.9NA个共用电子对 | |
| B. | 7.8gNa2O2固体中含阴离子数目为0.1NA | |
| C. | 含36.5gHCl的浓盐酸与足量的二氧化锰作用,能产生0.25NA个氯气分子 | |
| D. | 5.6gFe与足量的氯气反应转移的电子数目为0.2NA |
 .
.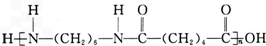 +(2n-1)H2O.
+(2n-1)H2O.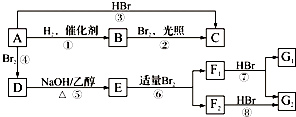
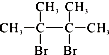 ,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答:
,F1和F2互为同分异构体,加成HBr时F1有两种加成产物,F2只有一种加成产物,G1和G2分别互为同分异构体.据此作答: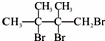 .
.