题目内容
18. 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2ΝΗ3(g)+CO2(g)
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2ΝΗ3(g)+CO2(g)实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总 浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.v正(NH3)=2v逆(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量将增加(填“增加”、“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
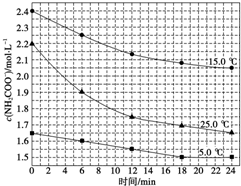
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
分析 (1)①根据达到平衡状态的特征:各组分浓度不再变化,正逆反应速率相等进行判断;
②根据化学平衡常数的表达式进行计算.
③根据平衡移动原理判断;
④根据温度对化学平衡移动的影响以及反应前后气体量的变化来确定焓变和熵变的符号;
(2)根据化学反应速率的公式V=$\frac{△c}{△t}$计算;
解答 解:(1)①A、没有标明正逆反应速率,无法判断平衡状态,故A不可以;
B、由于反应前后气体的化学计量数之和不相等,压强不变,达到了平衡状态,故B可以;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故C可以;
D、氨气体积分数不变,不能说明正逆反应速率相等,各组分浓度不变,故D不可以;
故选AD.
②根据反应:NH2COONH4(s)?2NH3(g)+CO2(g),n(NH3)=2n(CO2),所以K=c(CO2)=$\frac{1}{3}$×4.8×10-3mol•L-1=1.6×10-3mol•L-1,c(NH3)=$\frac{2}{3}$×4.8×10-3mol•L-1=3.2×10-3mol•L-1,依据平衡常数的表达式,25.0℃时氨基甲酸铵的分解平衡常数为:1.6×10-3mol•L-1×(3.2×10-3mol•L-1)2≈1.6×10-8(mol•L-1)3,
故答案为:K=1.6×10-8(mol•L-1)3;
③压缩容器体积,增大了压强,平衡向着逆向移动,氨基甲酸铵固体的质量增加,故答案为:增加;
④根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡正向移动,反应是吸热的,反应物是固体,产物是气体,该反应是熵增加的过程,即△H>0,△S>0,故答案为:>;>;
(2)化学反应速率V=$\frac{△c}{△t}$=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
点评 本题考查了化学平衡状态的判断,平衡常数的计算、反应速率的计算等,注重了基础知识的考查,本题难度中等.

| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 碳酸氢钠可用来治疗胃酸过多 |
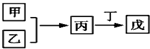 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| B. | 若丙、丁混合产生白烟,且丙为18电子分子,则乙的水溶液可能具有漂白作用 | |
| C. | 若甲、丙、戊含有同一种元素,该元素的化合价由低到高的顺序可能为甲<丙<戊 | |
| D. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 |
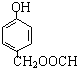
 )是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
)是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基香草醛分子中两种含氧官能团的名称:酚羟基、醛基,核磁共振氢谱显示该分子中有7种不同类型的氢原子.
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
.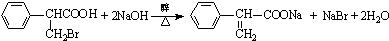 .
. )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
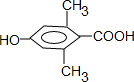 .
.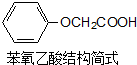 菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物.
菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物. 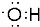 .
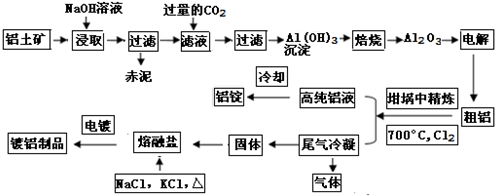
. .
.
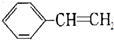 制取 聚苯乙烯
制取 聚苯乙烯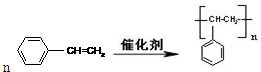 .
.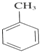 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$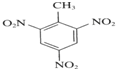 +3H2O.
+3H2O.