题目内容
【题目】氯酸镁[ Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量 Mg(ClO3)2·6H2O 的流程如下:
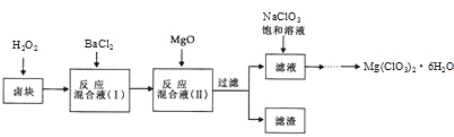
已知:①.卤块主要成分为 MgCl2·6H2O,含有 MgSO4、FeCl2等杂质。
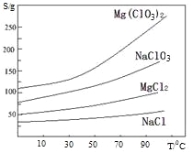
②.四种化合物的溶解度(S)随温度(T)变化曲线 如图所示。回答下列问题:
(1).过滤时主要的玻璃仪器有
(2).加入 BaCl2 的目的是除去杂质离子,检验已沉淀完全的方法是
( 3) .加入 H2O2 溶 液 的 作 用 是 : ; 加 入 MgO的 作 用是
(4).滤渣的主要成分为 。
(5).向滤液中加入 NaClO3 饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取 Mg(ClO3)2·6H2O 的实 验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6).产品中 Mg(ClO3)2·6H2O 含量的测定:
步骤 1:准确称量 3.50 g 产品配成 100 mL 溶液。
步骤 2:取 10.00 mL 于锥形瓶中,加入 10.00 mL 稀硫酸和 20.00mL 1.000 mol·L-1 的 FeSO4溶液,微热。
步骤 3:冷却至室温,用 0.l000mol·L-1 K2Cr2O7 溶液滴定剩余的Fe2+至终点,
此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
步骤 4:将步骤 2、3 重复两次,计算得平均消耗 K2Cr2O7 溶液 15.00 mL。
写出步骤 2 中发生反应的离子方程式(还原产物为Cl- )
产品中 Mg(ClO3)2·6H2O 的质量分数为【Mg(ClO3)2·6H2O 的相对分子质量为299,列出表达式即可)】
【答案】(1)漏斗、烧杯、玻璃棒;(2)静置,取上层清液适量于试管中,加入BaCl2溶液,若无白色沉淀生成,则SO42-沉淀完全(其他合理答案);
(3)使Fe2+氧化;调节溶液的pH,使Fe3+沉淀完全;
(4)BaSO4和Fe(OH)3;(5)蒸发浓缩、冷却结晶;
(6)①ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;②(11×299)/(12×3.50)%。
【解析】
试题分析:(1)过滤使用到的玻璃仪器有烧杯、漏斗、玻璃棒;(2)BaCl2除去的SO42-,因此检验已沉淀完全,需要检验SO42-,因此操作是:静置,取上层清液适量于试管中,加入BaCl2溶液,若无白色沉淀生成,则SO42-沉淀完全,也可以加入Na2SO4,如果有沉淀生成,说明BaCl2过量,沉淀完全;(3)杂质中含有Fe2+,加入过氧化氢,把Fe2+氧化成Fe3+;加入MgO的作用是调节溶液的pH,使Fe3+转化成Fe(OH)3;(4)根据(2)、(3)的分析,滤渣的主要成分是BaSO4和Fe(OH)3;(5)根据实验目的,制备Mg(ClO3)2·6H2O,因此实验步骤是蒸发浓度、趁热过滤、冷却结晶、过滤等;(6)①利用ClO3-的氧化性,把Fe2+氧化成Fe3+,本身被还原成Cl-,根据化合价的升降法进行配平,因此离子反应方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;②根据步骤3,求出剩余的Fe2+的物质的量为6×15×10-3×0.1mol=9×10-3mol,则步骤2中消耗的Fe2+的物质的量为(20×10-3×1-9×10-3)mol=11×10-3mol,根据离子反应方程式,反应的ClO3-的物质的量为11×10-3/6mol,因此Mg(ClO3)2·6H2O的质量分数为:11×10-3×299×100/(6×2×3.50×10)×100%。