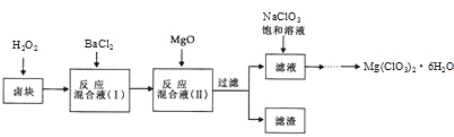
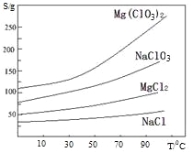
��Ŀ����
����Ŀ��ijѧϰС����ʵ������ȡCO2����Ĺ����У������õ���Ũ���ᣬ�����Ƶõ�CO2�����л���HCl���壬������������³�ȥHCl���岢̽��CO2��������ƣ�Na2O2����Ӧ��ʵ�顣����֪��2H2O + 2Na2O2 = 4NaOH + O2������ش��������⣺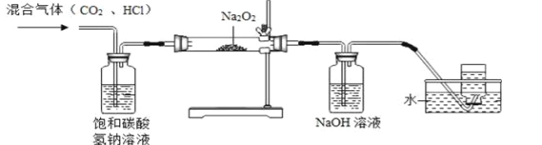
A B C D
��1��װ��A�������ǣ� ��
��2��Ϊȷ����Ӧ��װ��BӲ�ʲ������й���ijɷ֣�С��ͬѧȡ�����������Թ��У���������������ˮ�ܽ⣬�γ���ҺM�������ݲ�������ù����в��� ����С��ͬѧ��������̽����
��������⡿��Ӧ��Ӳ�ʲ������й���ijɷ���ʲô��
���������롿����һ��Na2CO3 �������NaOH ��������Na2CO3��NaOH���������ۣ����һ����Ϊ������������������ǣ� ���û�ѧ����ʽ��ʾ����
��ʵ����֤��С��ͬѧȡ�����γɵ���ҺM���Թ��У������м�������� ��Һ����������ɫ���������ˣ�����Һ�еμӼ��η�̪��Һ����Һ��죬��֤��������������
��������˼��С������ͬѧ��Ϊ����������Һ�еμӵķ�̪��Һ��������ͭ��Һ��Ҳ�ܵó�ͬ���Ľ��ۣ�����Ϊ��ͬѧ�Ĺ۵� �����ȷ�������������ǣ� ���û�ѧ����ʽ��ʾ����
����չ���졿��ʢ���Ȼ��Ũ��Һ���Թ��У����������Ĺ������ƣ�Na2O2�����壬�����ݲ����� �Թܿ�ʪ��ĺ�ɫʯ����ֽ������������������ ��
���𰸡���1����ȥHCl��������2��Na2O2��
���������롿������CO2+2NaOH=Na2CO3+H2O��2CO2+2Na2O2=2Na2CO3+O2
��ʵ����֤��BaCl2��Ba(NO3)2��CaCl2��Ca(NO3)2(1��)��
��������˼����ȷ(1��)��Cu(NO3)2+2NaOH=Cu(OH)2��+2NaNO3
����չ���졿O2��NH3
��������
�����������1�����ɵ�CO2�л����Ȼ������壬��װ��A�������dz�ȥCO2���Ȼ��⣻
(2)B�з�����Ӧ2Na2O2��2CO2��2Na2CO3��O2����������������ˮ�����ݲ�����˵������Na2O2��
���������롿A�г���������ΪCO2��H2O�����B�з����ķ�Ӧ�ǣ�2CO 2 + 2Na2O2 = 2Na2CO3 + O2��2H2O��2Na2O2=4NaOH��O2����CO 2 + 2NaOH = Na2CO3 + H2O��
��ʵ����֤���������к���Na2CO3����˼���BaCl2��Ba(NO3)2��CaCl2��Ca(NO3)2������ɫ������˵������Na2CO3���μӼ��η�̪����Һ��죬˵������NaOH��
��������˼����Һ�к���NaOH������Cu(NO3)2�������ɫ�����������ķ�Ӧ��Cu(NO3)2��2NaOH��Cu(OH)2����2NaNO3��
����չ���졿2Na2O2��2H2O=4NaOH��O2�����˷�Ӧ�Ƿ��ȷ�Ӧ��NaOH��NH4Cl= NH3����H2O��NaCl���������ΪO2��NH3�������Ǽ���������ʹʪ��ĺ�ɫʯ����ֽ������

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�����Ŀ�������������Һ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ�� Na2S203+H2S04=Na2S04+S02+S��+H20�����и���ʵ�������ȳ��ֻ��ǵ��ǣ� ��
ʵ�� | ��Ӧ������ | Na2SO4 | Na2S2O3 ��Һ | ϡ H2SO4 | H2O | |
V/mL | c/ (moL-L-1) | V/mL | d (moL-L-1) | V/mL | ||
A | 25 | 5 �� | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |