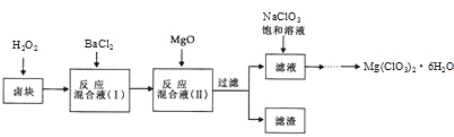
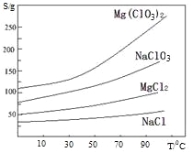
题目内容
【题目】关于气体体积,下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积不可能是22.4L
【答案】B
【解析】
试题分析:A.气体的体积取决于温度和压强的大小,在标准状况下,Vm=22.4L/mol,在其它条件下,1mol气体的体积不一定为22.4L,A错误;
B.根据n=![]() =
=![]() ,同温同压下两种气体,气体的分子个数与体积呈正比,B正确;
,同温同压下两种气体,气体的分子个数与体积呈正比,B正确;
C.在标准状况下,只有体积为22.4L的气体物质才是1mol,其它状态的物质的Vm≠22.4L/mol,C错误;
D.根据PV=nRT可知,并不是只有在标准状况下Vm=22.4L/mol,Vm取决于温度和压强的大小,D错误;答案选B。

练习册系列答案
相关题目