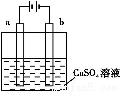
题目内容
下列叙述中,不正确的是( )
A.原电池是将化学能转化为电能的装置
B.轮船底部镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁腐蚀的负极反应:Fe-3e-=Fe3+
D.电镀时,镀层金属作阳极,镀件作阴极
C
【解析】A选项是原电池的定义,正确;轮船底部镶嵌锌块,锌铁形成原电池,锌作负极,是牺牲阳极的阴极保护法,B项正确;钢铁被腐蚀时,铁作负极,Fe-2e-=Fe2+,C选项错;D选项符合电镀的要求,正确。

练习册系列答案
相关题目
下表是三种难溶金属硫化物的溶度积常数(25 ℃)。
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
下列有关说法中正确的是( )
A.25 ℃时,CuS的溶解度大于MnS的溶解度
B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S CuS↓+H2SO4不能发生
CuS↓+H2SO4不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂