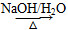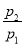题目内容
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
请回答下列问题:
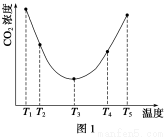
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH3________0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是____________________________________________________________________________。
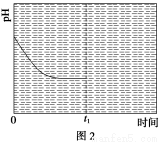
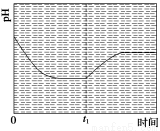
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有________________________(写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是__________。
A.NH4Cl B.Na2CO3
C.HOCH2CH2OH D.HOCH2CH2NH2
(2)①< ②T1~T2区间,化学反应未达到平衡,温度越高,化学反应速率越快,所以CO2被捕获的量随温度升高而提高。T4~T5区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,所以不利于CO2捕获
③
(3)降低温度,增加CO2浓度(或分压)
(4)BD
【解析】结合题给图像,用盖斯定律、化学平衡原理作理论指导进行分析、解决相关问题。
(2)①由图1可知,当温度为T3时,可逆反应达到平衡状态,温度升高,CO2的浓度逐渐增大,说明平衡逆向移动,正反应为放热反应,则有ΔH3<0。
②在T1~T2区间,此时可逆反应未达到平衡,温度升高,化学反应速率加快,平衡正向移动,CO2的捕获量随温度的升高而提高 。在T4~T5区间,此时可逆反应已达到平衡状态,由于该反应为放热反应,温度升高,平衡逆向移动,CO2的捕获量随温度的升高而降低。
③t1时刻,温度迅速升高到T2,平衡逆向移动,溶液的pH升高,根据化学平衡移动原理,达到新平衡时,溶液的pH低于开始时的pH。
(3)欲提高CO2的吸收量,应使平衡正向移动,可降低温度或增加CO2的浓度等。
(4)CO2为酸性氧化物,可用碱性溶液(如Na2CO3溶液)或碱性物质(如HOCH2CH2NH2)等来吸收。