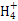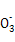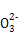题目内容
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,17 g甲基(—14CH3)所含的中子数为9NA
B.pH=1的稀硫酸中含有的H+数为0.1NA
C.7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA
D.3 mol NO2和足量H2O反应,转移NA个电子
C
【解析】—14CH3所含的中子数14-6=8,17 g甲基(—14CH3)是1 mol,所以含有8 mol中子,选项A不正确;因为没有告诉溶液的体积,无法求H+数,B不正确;过氧化钠与足量二氧化碳的反应中,过氧化钠既是氧化剂又是还原剂,1 mol过氧化钠参加反应转移1 mol电子,C正确;3NO2+H2O 2HNO3+NO,反应中NO2既作氧化剂又作还原剂,每3 mol NO2参加反应转移电子是2 mol,D不正确。
2HNO3+NO,反应中NO2既作氧化剂又作还原剂,每3 mol NO2参加反应转移电子是2 mol,D不正确。

练习册系列答案
相关题目
以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
离子 | 开始沉淀pH | 沉淀完全pH |
Fe2+ | 7.6 | 9.6 |
Fe3+ | 2.7 | 3.7 |
Zn2+ | 5.4 | 8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式 。
(2)步骤2中调节溶液pH的范围是 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。