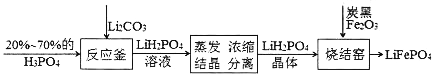
题目内容
【题目】已知pCa=-lgc(Ca2+),Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=2.8×10-9,向10 mL CaCl2溶液中滴加0.1mol/L的Na2SO4溶液时,溶液中pCa与Na2SO4溶液体积(V)的关系如图所示(实线),下列有关说法正确的是(已知1g3=0.48)
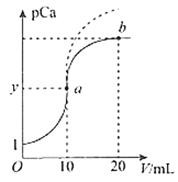
A. y值为3.48
B. a与b两点c(Ca2+)之比为50:3
C. 原CaCl2溶液浓度为1mol/L
D. 若把0.1mol/L的Na2SO4溶液换成0.1mol/L的Na2CO3溶液则图象在终点后变为虚线部分
【答案】D
【解析】
A.未滴加Na2SO4溶液时pCa=1,可知原溶液中c(Ca2+)=0.1mol/L,a点为滴加10mL0.1mol/L的Na2SO4溶液,此时恰好完全反应,此时溶液中c(Ca2+)= c(SO42-)=![]() mol/L=3.0×10-3mol/L,pCa=-lgc(Ca2+)=-lg(3.0×10-3)=3-lg3=2.52,即y值为2.52,故A错误;B.a点溶液中c(Ca2+)=3.0×10-3mol/L,b点溶液中加入Na2SO4的体积为20mL,则溶液中c(SO42-)=
mol/L=3.0×10-3mol/L,pCa=-lgc(Ca2+)=-lg(3.0×10-3)=3-lg3=2.52,即y值为2.52,故A错误;B.a点溶液中c(Ca2+)=3.0×10-3mol/L,b点溶液中加入Na2SO4的体积为20mL,则溶液中c(SO42-)=![]() mol/L,则此时溶液中c(Ca2+)=
mol/L,则此时溶液中c(Ca2+)=![]() mol/L=2.7×10-4mol/L,所以a点和b点溶液中c(Ca2+)之比为(3.0×10-3mol/L):(2.7×10-4mol/L)=100:9,故B错误;C.未滴加Na2SO4溶液时pCa=1,可知原溶液中c(Ca2+)=0.1mol/L,原CaCl2溶液浓度为0.1mol/L,故C错误;D.CaSO4的溶解度比CaCO3的大,前者Ksp数值更大,因此在使用相同量的Na2CO3溶液代替Na2SO4溶液时,溶液中Ca2+下降的快,则pCa值相对较大,图象应在原图像上方,故D正确;故答案为D。
mol/L=2.7×10-4mol/L,所以a点和b点溶液中c(Ca2+)之比为(3.0×10-3mol/L):(2.7×10-4mol/L)=100:9,故B错误;C.未滴加Na2SO4溶液时pCa=1,可知原溶液中c(Ca2+)=0.1mol/L,原CaCl2溶液浓度为0.1mol/L,故C错误;D.CaSO4的溶解度比CaCO3的大,前者Ksp数值更大,因此在使用相同量的Na2CO3溶液代替Na2SO4溶液时,溶液中Ca2+下降的快,则pCa值相对较大,图象应在原图像上方,故D正确;故答案为D。

【题目】回答下列问题:
(1)用“>”或“<”填写下表。
非金属性 | 熔点 | 沸点(同压) | 键能 |
P___S | MgO ___CaS | CF4 ___SiCl4 | H-Cl___H-Br |
(2)一种制取NH2OH的反应为2NO2-+4SO2+6H2O+6NH3=4S042-+6NH4++2NH2OH。
①N、H、O的电负性从小到大的顺序为____。
②NH2OH中N原子的杂化类型为____。
③NHOH极易溶于H2O,除因为它们都是极性分子外,还因为____。
(3)配合物K[PtCl3(NH3)]中[PtCl3(NH3)]-的结构可用示意图表示为_____(不考虑空间构型),1molK[PtCl3(NH3)]中含有σ键的数目为____。