��Ŀ����
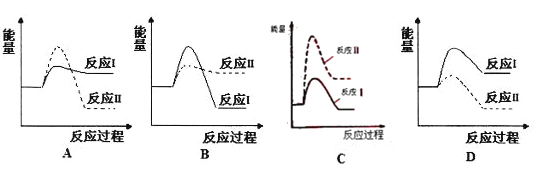
����Ŀ����һ���¶��£���һ����̶����ܱ������м���2 mol X��1 mol Y���������·�Ӧ��2X(g)��Y(g) ![]() a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X��ת����Ϊ����ƽ����������¶ȣ���������ƽ����Է���������С����
a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X��ת����Ϊ����ƽ����������¶ȣ���������ƽ����Է���������С����
��1���¶����ߣ�ƽ�ⳣ��K��ֵ��____________(���������С�����䡱)��
��2����ѧ������a��ֵΪ____________��
��3����ͬѧ��Ϊ��Q1һ��С��Q������Ϊ�ý����Ƿ���ȷ��________����������___________________��
��4��ά���¶Ȳ��䣬����ʼʱ�������м�������ʵ��������и����Ӧ�ﵽƽ���ų���������ΪQ1 kJ����____________(ϡ�����岻���뷴Ӧ)��
A��2 mol X��1 mol Y��1 mol Ar
B��a mol Z��1 mol W
C��1 mol X��0.5 mol Y��0.5a mol Z��0.5 mol W
D��2 mol X��1 mol Y��1 mol Z
��5��X��ת��������____________(�ú�Q��Q1�Ĵ���ʽ��ʾ)��
���𰸡���С 1 ��ȷ 2 mol X��1 mol Y��������ȫ��Ӧ A ![]() ��100%
��100%
��������
(1)������Ӧ�Ƿ��ȷ�Ӧ������ƽ���ƶ�ԭ��������ƽ�������ȷ�Ӧ���������ƽ�����������ƽ�ⳣ����С��
(2)�����Ϣ����֪��ƽ����������¶���ƽ�������������������ƽ����Է���������С����Ӧǰ���������������������������ʵ���������2+1>a+1��a<2����ѧ����ʽ��ϵ��Ϊ��������a=1��
(3)�ʱ�������Ƕ�Ӧ��Ӧǰ����ɵ������仯����һ����̶����ܱ������м���2 mol X��1 mol Y��Ӧ�ǿ��淴Ӧ�ﵽƽ��״̬��X��Y������ȫ��Ӧ������
(4) ѡ��A����ϡ�������ƽ����Ӱ�����ų�������������ѡ��B����Ӧ���淴Ӧ��ʼ����Ӧ����������ѡ��C��D���з�Ӧ������ƽ��ʱ�ų���������С��Q1 kJ��
��5�������Ȼ�ѧ����ʽ������ϵ��Ϸų�������������X���ʵ�����ת����=![]() ��100%��
��100%��
(1)�������·�Ӧ��2X(g)��Y(g) ![]() a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)���ʱ�Ϊ��ֵ���Ƿ��ȷ�Ӧ������ƽ���ƶ�ԭ������������ƽ�����������ƽ�ⳣ����С��
a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)���ʱ�Ϊ��ֵ���Ƿ��ȷ�Ӧ������ƽ���ƶ�ԭ������������ƽ�����������ƽ�ⳣ����С��
��ˣ�������ȷ��������С��
(2)��Ӧ��������ƽ����������¶�����ƽ�������ƶ�����������ƽ����Է���������С��˵����Ӧ������Ļ�ѧ������֮�ʹ�������������Ļ�ѧ������֮������2+1>a+1��a<2��
��ˣ�������ȷ������1��
(3) 2X(g)��Y(g) ![]() a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)���ʱ���ָ2 mol X��1 mol Y��ȫ��Ӧ����QkJ������2 mol X��1 mol Y����Ӧ�ﵽƽ��״̬��X��Y��������ȫ��Ӧ���ڷ���С��Q��
a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)���ʱ���ָ2 mol X��1 mol Y��ȫ��Ӧ����QkJ������2 mol X��1 mol Y����Ӧ�ﵽƽ��״̬��X��Y��������ȫ��Ӧ���ڷ���С��Q��
��ˣ�������ȷ��������ȷ��2 mol X��1 mol Y��������ȫ��Ӧ��
(4) ѡ��A����ϡ�������ƽ����Ӱ�����ų�������������
ѡ��B����Ӧ���淴Ӧ��ʼ����Ӧ����������
ѡ��C��D���з�Ӧ������ƽ��ʱ�ų���������С��Q1 kJ��
��ˣ�������ȷ������A��
(5)������Ӧ��2X(g)��Y(g) ![]() a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X���ʵ���=
a Z(g)��W(g) ��H����Q kJ��mol��1(Q��0)������Ӧ�ﵽƽ���Ӧ�ų�������ΪQ1 kJ������X���ʵ���=![]() mol��
mol��
X��ת����=![]() ��100%=
��100%=![]() ��100%��
��100%��
�ʴ�Ϊ��![]() ��100%��
��100%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ҵ����������ˮ��̼���ȣ�SrCO3����ĩΪԭ�ϣ��������������Ļ�����Ʊ��ߴ���ˮ�Ȼ��Ⱦ��壨SrCl2��6H2O���������Ϊ��

��֪�������й��������������pH��
�������� | Fe(OH)3 | Fe(OH)2 |
��ʼ������pH | 1.5 | 6.5 |
������ȫ��pH | 3.7 | 9.7 |
��SrCl2��6H2O ������61��ʱ��ʼʧȥ�ᾧˮ��100��ʱʧȥȫ���ᾧˮ��
��ش�
��1��д��̼���������ᷴӦ�����ӷ���ʽ_______________��
��2���ڲ�����У���Ҫ����Һ��pH��1������3.7���ϣ�����ѡ�õ��Լ�Ϊ__________��дһ�֣���
��3���������������и������˵������ȷ����_____________��
A������pH�������е�ԭ���dz�ȥH2O2������������Fe(OH)3����
B������ܰ�����60�����ˮԡ������������Һ������־�Ĥ����ȴ�ᾧ
C������ͨ���ӿ�ᾧ���ʵķ������õ��ϴ������SrCl2��6H2O ����
D���������SrCl2��6H2O������Բ��ü�ѹ����
��4��Ϊ�˲ⶨ����SrCl2��6H2O������Ʒ�Ĵ��ȣ���������·�������ȡ1.40g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 2.38g��AgNO3��Һ����Һ�г�Cl���⣬����������Ag+��Ӧ���ɳ��������ӣ���Cl������ȫ��������Ȼ���ú�Fe3+����Һ��ָʾ������0.200mol��L��1��NH4SCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+��AgSCN��ɫ��������ʽ��������_______________ʱ�ﵽ�ζ��յ㣬��ȥNH4SCN��Һ20.0mL����ԭSrCl2��6H2O����Ĵ���Ϊ_________________________��