题目内容
【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2

(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。

①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
【答案】> H3 = H1+H2 < AD A CO2 + H2O + 2e- == HCOOH+O2- > 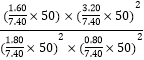
【解析】
(1)反应C(s)+H2O(g)==CO(g)+H2(g)中S>0,G=H-TS<0,根据该反应在高温下能自发进行,则H>0;
(2) ①已知(a)2H2(g)+CO(g)![]() CH3OH(g) H1
CH3OH(g) H1
(b)H2(g)+CO2(g)![]() H2O(g)+CO(g) H2
H2O(g)+CO(g) H2
根据盖斯定律,由(a)+ (b)得反应(c)3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g) H3=H1+H2;
CH3OH(g)+H2O(g) H3=H1+H2;
根据反应可得K3= K1K2,由表中数据计算得5000C、7000C、8000C时的值分别为2.5×1.0=2.5、0.34×1.70=0.578、0.15×2.52=0.378,故升高温度K3值减小,反应(c)为放热反应,H3<0;
②要使n(CH3OH):n(CO2)增大,应使平衡向正反应方向移动,
A.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH):n(CO2)增大,选项A正确;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH):n(CO2)不变,选项B错误;
C.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH):n(CO2)减小,选项C错误;
D.再充入1mol H2,平衡向正反应方向移动,则n(CH3OH):n(CO2)增大,选项D正确。
答案选AD;
③ 500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则Q=![]() ,此时反应(c)向正反应方向进行,答案选A;
,此时反应(c)向正反应方向进行,答案选A;
(3)电解池中阴离子定向移动到阳极,根据氧离子定向移动到b极,则b极为阳极,CO2和水在a处得电子转化为HCOOH,在电解池中阴极上得电子发生还原反应,故阴极的电极反应为CO2 + H2O + 2e- == HCOOH+O2-;
(4) ①反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1为放热反应,升高温度平衡逆向移动,NO的转化率降低,故T1>T2;
N2(g)+2CO2(g) △H = -746 kJ·mol-1为放热反应,升高温度平衡逆向移动,NO的转化率降低,故T1>T2;
② 某温度下,反应达到平衡状态P点时,NO的转化率为80%,则平衡时CO、NO、N2、CO2的物质的量分别为1.8mol、0.8mol、1.6mol、3.2mol,平衡时气体总物质的量为7.4mol,总压为50MPa,各气体的分压为![]() 、
、![]() 、
、![]() 、
、![]() ,此时的平衡常数Kp=img src="http://thumb.zyjl.cn/questionBank/Upload/2019/05/10/08/e68ff7ce/SYS201905100837397580273619_DA/SYS201905100837397580273619_DA.001.png" width="144" height="60" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。
,此时的平衡常数Kp=img src="http://thumb.zyjl.cn/questionBank/Upload/2019/05/10/08/e68ff7ce/SYS201905100837397580273619_DA/SYS201905100837397580273619_DA.001.png" width="144" height="60" style="-aw-left-pos:0pt; -aw-rel-hpos:column; -aw-rel-vpos:paragraph; -aw-top-pos:0pt; -aw-wrap-type:inline" />。

 期末集结号系列答案
期末集结号系列答案




