题目内容
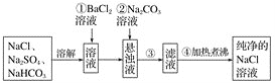
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是
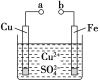
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D. a和b用导线连接时,铁片作正极
【答案】D
【解析】
A.a和b不连接时,发生Fe+Cu2+=Cu+Fe2+置换反应,则铁片上会有金属铜析出,故A正
确;
B.a和b用导线连接时,Cu为正极,在正极上阳离子得电子,则发生Cu2++2e-=Cu,故B正确;
C.无论a和b是否用导线连接,均发生Fe+Cu2+=Cu+Fe2+,则铁片均溶解,溶液从蓝色逐渐变成浅绿色,故C正确;
D. a和b用导线连接时,形成原电池,铜片作正极,铁片作负极,故D错误。
故选D。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
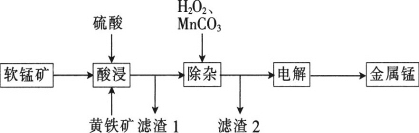
已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。
【题目】碳、氮及其化合物在生产、生活中广泛存在。
(1)煤气化的化学方程式为:C(s)+H2O(g)==CO(g)+H2(g) H,该反应在高温下能自发进行,则H_____0(填“>”或“<”)。
(2)煤气化的产物可用于合成甲醇。已知,在刚性容器中,有关反应及其在不同温度下的化学平衡常数如下表所示。
相关化学反应方程式 | 平衡 常数 | 温度(0C) | ||
500 | 700 | 800 | ||
(a)2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
(b)H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
(c)3H2(g)+CO2(g) | K3 | |||
①H1、H2、H3的关系是_____________,H3______0 (填“>”或“<”)
②下列措施能使反应(c)的平衡体系中n(CH3OH):n(CO2)增大的是_______(填字母代号)。
A.将H2O (g)从体系中分离出去 B.充入He (g)
C.升高温度 D.充入1mol H2 (g)
③500℃时,测得反应(c)在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为1.0mol·L-1、0.20mol·L-1、0.50mol·L-1、0.40mol·L-1,则此时反应(c)________。
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断反应状态
(3)CO2
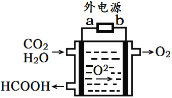
(4)汽车尾气主要有害物质是CO和NO,提高其转化效率是重要的研究课题。在密闭容器中充入5.0 mol CO和4.0 mol NO,发生以下反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
N2(g)+2CO2(g) △H = -746 kJ·mol-1平衡时,NO的转化率与温度、压强的关系如图所示。
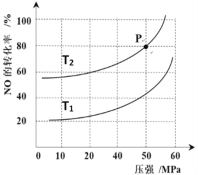
①温度:T1_____T2(填“<”或“>”),
② 某温度下,反应达到平衡状态P点时,此时的平衡常数Kp=________________________(只列计算式)。
【题目】1-丁醇(液体)中溶有一种杂质,现利用下列方法提纯1-丁醇,路线如下:
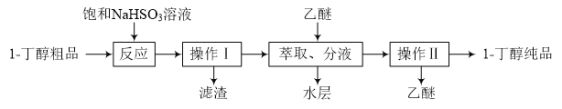
已知1-丁醇、乙醚的部分性质如下表所示:
物质 | 沸点 | 密度 | 溶解性 |
1-丁醇 | 117.7℃ | 0.81g/cm3 | 能溶于水,易溶于乙醚 |
乙醚 | 34.6℃ | 0.71g/cm3 | 微溶于水 |
(1)加入饱和NaHSO3溶液的目的是______。
(2)操作Ⅱ的名称是______。
(3)萃取、分液所用的玻璃仪器的名称是______。为使1-丁醇尽可能多地从水中转移到乙醚中,萃取时向装有1-丁醇水溶液的仪器中加入一定量的乙醚,______、静置、分液,并重复多次。