题目内容
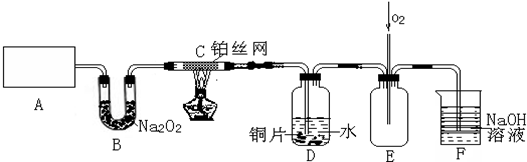
1.某学生利用以下装置探究氯气与氨之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置.请回答下列问题: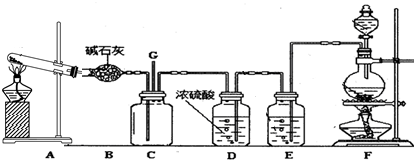
(1)装置A中发生反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;装置F中发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)装置E中盛装的溶液是饱和食盐水;装置E的作用是吸收氯气中的氯化氢;
(3)装置B能否用装置D替换,原因是氨气能够与浓硫酸反应,氯气能够与碱石灰反应;
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.写出反应的化学方程式8NH3+3Cl2═6NH4Cl+N2;
(5)将用F、E、D装置制得的氯气通人石灰乳中,可制得漂粉精.有效氯是漂粉精中有效Ca(CIO)2的含量大小的标志.已知:有效氯=$\frac{漂粉精加盐酸所释放出的氯气的质量}{漂粉精的质量}$×100%,该漂粉精的有效氯为55%,则该漂粉精中Ca(CIO)2的质量分数为55.4%(保留一位小数).
分析 (1)氯化铵和氢氧化钙在加热条件下能反应生成氯化钙、氨气和水;实验室用浓盐酸和二氧化锰加热制取氯气;
(2)依据浓盐酸具有挥发性,可知制取的氯气中含有氯化氢、水蒸气,要收集干燥纯净的氯气,应除去氯化氢、水蒸气;
(3)氨气为碱性气体应选择碱性干燥剂;氯气为酸性气体应选择酸性干燥剂;
(4)由题意可知发生反应为氨气和氯气生成氯化铵和氮气,依据原子个数、得失电子守恒写成反应方程式;
(5)氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,盐酸与次氯酸钙反应生成氯气,依据反应方程式计算产生氯气,依据有效氯=$\frac{漂粉精加盐酸所释放出的氯气的质量}{漂粉精的质量}$×100%解答.
解答 解:(1)氯化铵和氢氧化钙在加热条件下能反应生成氯化钙、氨气和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;实验室用浓盐酸和二氧化锰加热制取氯气,反应方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,依次通过盛有饱和食盐水洗气瓶E、盛有浓硫酸洗气瓶D可以除去氯化氢和水蒸气;
故答案为:饱和食盐水;吸收氯气中的氯化氢;
(3)氨气为碱性气体应选择碱性干燥剂,浓硫酸为酸性干燥剂,能够与氨气反应,不能干燥氨气;
氯气为酸性气体应选择酸性干燥剂,碱石灰为碱性干燥剂,能够吸收氯气,不能干燥氯气;
故:氨气能够与浓硫酸反应,氯气能够与碱石灰反应;
(4)氨气和氯气反应生成白烟氯化铵和空气的主要成分之一氮气,即8NH3+3Cl2═6NH4Cl+N2,故答案为:8NH3+3Cl2═6NH4Cl+N2;
(5))氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,盐酸与次氯酸钙反应生成氯气,方程式:
Ca(ClO)2+4HCl=2Cl2↑+CaCl2+2H2O,
143 2
m[Ca(ClO)2]m(Cl2)
根据方程式可以得到漂白精加盐酸所释放的氯气的质量=$\frac{71×2}{143}$×m[Ca(ClO)2]=99.3%×m[Ca(ClO)2],
所以漂白精的质量=$\frac{99.3%}{55%}$×m[Ca(ClO)2]=180.5%×m[Ca(ClO)2],所以该漂粉精中Ca(ClO)2的质量分数=$\frac{1}{180.5%}$=55.4%,
故答案为:55.4%.
点评 本题考查了氯气的有关知识,熟悉氯气的制备原理和性质是解题关键,难度中等,注意有效氯的计算方法.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案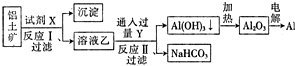
| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | 结合质子(H+)的能力由强到弱的顺序是AlO${\;}_{2}^{-}$>OH->CO${\;}_{3}^{2-}$ | |
| D. | 反应Ⅰ、Ⅱ均为氧化还原反应 |
| A. | 2mol铁原子 | B. | 1molFe3+ | C. | 0.5mol氧 | D. | 0.5mol氮气 |
| A. | 0.1 mol•L-1的硫酸铵溶液中:c(SO42->c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 1.0×l0-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| D. | 常温下,1mLpH=1的盐酸与l00mL pH=11的NaOH溶液混合后,溶液的pH=7 |
| A. | 任何一种微观粒子的摩尔质量以g/moL为单位时,其数值与该种粒子的相对分子(或原子)质量相同 | |
| B. | 物质的量是含有一定粒子数目的粒子的集合体 | |
| C. | 阿伏加德罗常数个微粒数就是12g12C原子所含的碳原子数 | |
| D. | 物质的量就是物质的质量 |
| A. | 含氧元素的化合物都是氧化物 | B. | 含氢元素的化合物都是酸 | ||
| C. | 冰水混合物不是纯净物 | D. | 只含一种元素的物质不一定是单质 |