题目内容
11.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如图.对上述流程的判断正确的是( )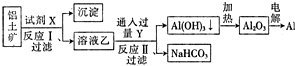
| A. | 试剂X为稀硫酸 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | 结合质子(H+)的能力由强到弱的顺序是AlO${\;}_{2}^{-}$>OH->CO${\;}_{3}^{2-}$ | |
| D. | 反应Ⅰ、Ⅱ均为氧化还原反应 |
分析 综合分析工艺流程图可知,试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①过滤后所得溶液A为NaAlO2溶液,沉淀为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤后分离后,电解熔融Al2O3属于氧化还原反应,以此解答该题.
解答 解:综合分析工艺流程图可知,试剂X是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①过滤后所得溶液A为NaAlO2溶液,沉淀为Fe2O3;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤后分离后,电解熔融Al2O3属于氧化还原反应,
A.分离氧化铝和氧化铁,只能用氢氧化钠溶液,不可能用酸,因氧化铝与氢氧化钠反应,氧化铁不反应,但二者都可与酸反应,故A错误;
B.铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C.结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C错误;
D.反应Ⅰ、Ⅱ是复分解反应,不属于氧化还原反应,故D错误.
故选B.
点评 本题以铁、铝化合物的性质为载体综合考查工业冶炼铝等知识,侧重于考查学生分析和解决问题的能力,综合性强,为高考常见题型,注意把握制备原理和反应的流程,难度中等.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 3种 | B. | 5种 | C. | 6种 | D. | 11种 |
| A. | 使用分液漏斗前应先检查其是否漏液 | |
| B. | 可以选用苯、汽油、酒精和四氯化碳为萃取剂 | |
| C. | 若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色 | |
| D. | 分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出 |
| A. | 若a=b+c时,B的物质的量分数不变 | B. | 若a<b+c时,A的转化率减小 | ||
| C. | 若a<b+c时,B的物质的量浓度减小 | D. | 若a>b+c时,A的物质的量分数减小 |
| A. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| B. | 1 mol CO2与1 L 2 mol•L-1的NaOH溶液反应后,溶液中CO32-数为NA | |
| C. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 | |
| D. | 2.7 g铝与3.36 L氯气充分反应,转移电子数一定为0.3 NA |
LaNi5H6+6NiO(OH)$?_{充电}^{放电}$LaNi5+6Ni(OH)2
下列说法不正确的是( )
| A. | 反应过程中,化合价发生变化的元素是镍、镧 | |
| B. | 该电池放电时,负极反应为:LaNi5H6+6OH--6e-=LaNi5+6H2O | |
| C. | 市面上出售的标称容量为 2000 mA•h的1节镍氢电池至少应含有镧镍合金5.4 g(已知 1法拉第电量为96500库仑或安培•秒) | |
| D. | 充电电池放电后可以再充电使活性物质获得再生,但实际上充放电次数仍有限制 |
| A. | KMnO4→K2MnO4 | B. | PCl3→PCl5 | C. | CO2→CO32- | D. | NO3-→NO |