题目内容
10.下列说法正确的是( )| A. | 含氧元素的化合物都是氧化物 | B. | 含氢元素的化合物都是酸 | ||
| C. | 冰水混合物不是纯净物 | D. | 只含一种元素的物质不一定是单质 |
分析 A.根据氧化物的概念解答;
B.根据酸的概念解答;
C.由同种分子构成的物质叫纯净物;
D.一种元素可构成不同的单质,它们互为同素异形体.
解答 解:A.由两种元素组成,其中一种元素是氧元素的化合物都是氧化物,故A错误;
B.酸指电离时生成的阳离子全部是氢离子(H+)的化合物,含有氢元素的化合物不一定是酸,如H2O,故B错误;
C.冰和水的组成相同,所以冰水混合物属于纯净物,故C错误;
D.只含一种元素的物质不一定是单质,如O2和O3形成的混合物,故D正确;
故选D.
点评 本题主要考查了物质的分类,注意概念的掌握,能够举出反例,难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
20.下列反应必须加入氧化剂才能实现的是( )
| A. | KMnO4→K2MnO4 | B. | PCl3→PCl5 | C. | CO2→CO32- | D. | NO3-→NO |
5.以铬铁矿(主要成分是FeO•Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取Na2CrO4晶体的工艺流程如下:
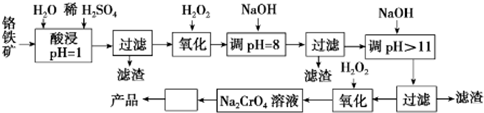
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO${\;}_{2}^{-}$形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)写出流程中第2次使用H2O2时,发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O;2CrO2-+3H2O2+2OH-═2CrO42-+4H2O.
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是蒸发浓缩、冷却结晶.
(4)CrO42-在酸性条件下转化为Cr2O72-.工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再调节溶液的pH=9,使金属离子生成沉淀而除去.

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO${\;}_{2}^{-}$形式存在且易氧化;②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
(2)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?不能,当pH=8时Al3+已经完全转化为Al(OH)3,若不经过滤除去,当继续加入NaOH时Al(OH)3会溶解,引入杂质离子AlO2-.
(3)流程图中从Na2CrO4溶液至产品中间“□”内的操作是蒸发浓缩、冷却结晶.
(4)CrO42-在酸性条件下转化为Cr2O72-.工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72-转化为Cr3+,该反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,再调节溶液的pH=9,使金属离子生成沉淀而除去.
2.下列有关化学反应类型的判断不正确的是( )
| A. | CH2=CH2+Cl2→CH2ClCH2Cl 加成反应 | |
| B. | 2CH3CHO+O2→2CH3COOH 加成反应 | |
| C. | CH3COOCH2CH3+H2O→CH3COOH+CH3CH2OH 取代反应 | |
| D. | C6H6+H2SO4→C6H5-SO3H+H2O 取代反应 |