题目内容
【题目】下列实验操作能达到目的的是( )
选项 | 实验目的 | 实验操作 |
A | 配制100 g10%的NaOH溶液 | 称取10 gNaOH溶于90 g蒸馏水中 |
B | 验证“84消毒液”呈碱性 | 用pH试纸测量溶液的pH |
C | 检验溶液中是否含有Na+ | 用洁净的玻璃棒蘸取溶液灼烧,观察火焰颜色 |
D | 从溴水中获得溴单质 | 利用SO2将Br2吹出后,富集、还原、分离 |
A.AB.BC.CD.D
【答案】A
【解析】
A. 溶液质量是90 g+10g=100 g,溶质的质量分数为![]() ×100%=10%,A正确;
×100%=10%,A正确;
B. “84消毒液”有效成分是NaClO,该物质具有氧化性,会将pH试纸氧化漂白,因此不能用pH试纸测量该溶液的pH,以验证溶液的碱性,B错误;
C. 玻璃的成分中含有Na2SiO3,含有钠元素,因此用玻璃棒进行焰色反应实验,就会干扰溶液中离子的检验,要使用铂丝或光洁无锈的铁丝进行焰色反应,C错误;
D. 向溴水中加入CCl4充分振荡后,静置,然后分液,就可从溴水中获得溴单质。若向溴水中通入SO2气体,就会发生反应:SO2+Br2+2H2O=H2SO4+2HBr,不能将单质溴吹出,D错误;
故合理选项是A。

【题目】某学习小组探究SO2与Cu(OH)2悬浊液的反应。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl- 、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+![]() Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+![]() Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是____________________。
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________。
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________。
④生成CuCl的离子方程式是____________________。
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________。
编号 | 实验 | 现象 |
III | 向Cu(OH)2固体中加入一定量的水,制得悬浊液(pH≈8),向悬浊液中通入SO2 | a. 底部产生少量浅黄色沉淀,慢慢消失 b. 静置,底部产生少量红色固体 |
IV | 向CuSO4溶液中通入SO2 | 无沉淀产生 |
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是____________________。
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有____________________。
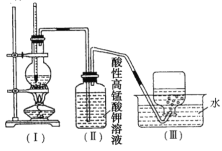
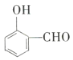
【题目】下列实验方案能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验溴乙烷中的溴原子 | 加入 |
B | 检验溴乙烷发生了消去反应 | 加 |
C | 除去溴苯中的溴 | 用 |
D | 确定乙醇分子的结构 | 通过质谱仪进行质谱分析 |
A.AB.BC.CD.D