题目内容
【题目】在工业废气和汽车尾气中含有多种氮氧化物,主要是NO 和NO2,都以NOx来表示。NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的主要来源之一。回答下列问题:
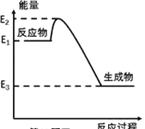
(1)已知 1mol 分子分解为单个原子所需要的能量为解离焓。 N2(g)、NO(g)、O2(g)的解离焓分别为941.7、631.8、493.7(单位kJ/mol),计算反应 2NO(g) = N2(g) + O2(g)的△H=_______kJ/mol,试判断NO(g)常温、常压下能否自发分解 ________填能或不能)。
(2)为防止光化学烟雾,除从工厂、汽车的设计进行改进外,也要采用某些化学方法。用焦炭还原NOx 的反应为2NOx(g) + xC(s)N2(g) + xCO2(g)
Ⅰ.在恒温条件下,2 molNO2(g)和足量 C(s)反应,测得平衡时 NO2(g)和 CO2(g)的物质的量浓度与平衡总压的关系如图所示:
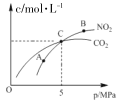
①A、B两点NO2平衡转化率的关系α(A)____α(B),平衡常数关系K(A)_____K(B)(填>、<或=)。
②计算C点时该反应的压强平衡常数Kp=_____MPa(Kp是用平衡分压代替平衡浓度)计算,分压=总压×物质的量分数)。
Ⅱ.现在向容积均为 2L 的两个密闭容器A、B中加入一定量的 NO(g)和足量的C(s),相同温度下测得两容器中n(NO)随时间变化情况如表所示:
0 | 20 | 40 | 60 | 80 | |
n(NO)/mol(A) | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
n(NO)/mol(B) | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
B容器内反应在 100s时达到平衡状态,则0~100s内用 NO 表示的平均反应速率为v(NO)= ____________。
(3)近年来电化学方法在处理氮氧化物方面也起到了一定的作用,如图是一种氨气一二氧化氮燃料电池,常温下可将二氧化氮转化为氮气。

①c口通入的气体为______ ,写出负极反应的方程式 ________。
②若a、d口产生的气体体积共为1.568L(标况下),电路中通过的电子数为____。
【答案】-171.8 能 > = 1 3×10-3 mol·L-1·s-1 NO2 2NH3-6e-=N2+6H+ 0.24 NA
【解析】
(1)根据解离焓的定义和焓变的定义可知焓变应等于反应物的解离焓之和-生成物的解离焓之和,所以反应2NO(g) = N2(g) + O2(g)的△H =2×631.8kJ/mol-(941.7 kJ/mol+493.7 kJ/mol)= -171.8 kJ/mol;该反应熵变不大,而该反应△H<0,所以常温常压下△H-T△S<0,所以该反应可以自发进行;
(2)Ⅰ. NO2(g)和C(s)反应方程式为2NO2(g) + 2C(s)N2(g) + 2CO2(g);
①该反应为气体体积增大的反应,增大压强平衡会左移,即压强越大NO2的平衡转化率越小,A、B两点均为平衡点,而B点的压强大于A点,所以转化率α(A)>α(B);该反应在恒温条件下进行,温度不变平衡常数不变,所以K(A)=K(B);
②初始投料为2 molNO2和足量 C,容器体积为2L,C点NO2和CO2的浓度相等,设生成的CO2物质的量为x,根据反应方程式2NO2(g)+2C(s)N2(g)+2CO2(g)可知剩余的NO2的物质的量为(2-x)mol,则有x=2-x,所以此时容器中n(NO2)=n(CO2)=1mol,n(N2)=0.5mol;总压强为5MPa,则p(NO2)=p(CO2)=![]() =2MPa,p(N2)=1MPa,Kp=
=2MPa,p(N2)=1MPa,Kp=![]() =1;
=1;
Ⅱ. NO(g)和C(s)反应方程式为2NO(g)+C(s)N2(g)+CO2(g),该反应前后气体体积不变,且反应为C为固体,所以相同温度下不同容器中通入不同量的NO,最终达到的均为等效平衡;据表格数据可知A容器60s时已经到达平衡,初始投料A容器中NO的物质的量时B容器的二倍,二者达到等效平衡,所以平衡时B容器中n(NO)=0.4mol,容器体积为2L,所以0~100s内用 NO 表示的平均反应速率为v(NO)= = 3×10-3 mol·L-1·s-1;
= 3×10-3 mol·L-1·s-1;
(3)该装置为原电池,根据氢离子的移动方向可知右侧为正极,得电子发生还原反应,左侧为负极,失电子发生氧化反应;
①右侧为正极,正极发生还原反应,该过程中二氧化氮转化为氮气被还原,应发生在正极区,即c口通入的气体为NO2;氨气在负极被氧化成氮气,电极方程式为:2NH3-6e-=N2+6H+;
②该电池工作时,正极反应为6NO2+24H++24e-=3N2+12H2O,负极反应为8NH3-24e-=4N2+24H+,可知转移24mol电子时,正极产生3mol气体,负极产生4mol气体,共7mol气体,标况下1.568L的物质的量为0.07mol,所以转移的电子为0.24mol,数目为0.24NA。

 特高级教师点拨系列答案
特高级教师点拨系列答案