题目内容
【题目】请据以下物质回答下列问题(填序号)
①浓H2SO4②液态SO2③纯醋酸④硫酸氢钠固体⑤铜⑥NaOH溶液 ⑦熔融的KCl ⑧酒精
(1)属于强电解的是________
(2)属于强电解质且在上述状态下能导电的是________,属于非电解质但溶于水后能导电的是_____
(3)写出下列物质在水中的电离方程式: 硫酸氢钠固体:_______醋酸:______
【答案】④⑦ ⑦ ② NaHSO4=Na++ H++SO4— CH3COOH![]() CH3COO-+H+
CH3COO-+H+
【解析】
在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,完全电离的电解质是强电解质,只有部分电离的电解质是弱电解质,能导电的物质中含有自由移动的阴阳离子或自由移动的电子.
①浓H2SO4是混合物,不属于强电解质,但不能导电;
②液态SO2属于非电解质,但其水溶液能导电;
③纯醋酸属于弱电解质,其水溶液能导电;
④硫酸氢钠固体属于强电解质,但不能导电;
⑤铜是单质,既不是电解质也不是非电解质,但能导电;
⑥NaOH溶液含有自由移动的阴阳离子,但属于混合物,既不是电解质也不是非电解质;
⑦熔化的KCl含有自由移动的阴阳离子,所以能导电,且属于强电解质;
⑧酒精(C2H5OH)属于非电解质,但其水溶液不导电;
(1) 属于强电解的是④⑦;
(2) 属于强电解质且在上述状态下能导电的是⑦;属于非电解质但溶于水后能导电的是②;
(3) 硫酸氢钠固体溶于水的电离方程式是:NaHSO4=Na++ H++SO4—;醋酸:CH3COOH![]() CH3COO-+H+,
CH3COO-+H+,
故答案为:NaHSO4=Na++ H++SO4—;CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在工业废气和汽车尾气中含有多种氮氧化物,主要是NO 和NO2,都以NOx来表示。NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的主要来源之一。回答下列问题:
(1)已知 1mol 分子分解为单个原子所需要的能量为解离焓。 N2(g)、NO(g)、O2(g)的解离焓分别为941.7、631.8、493.7(单位kJ/mol),计算反应 2NO(g) = N2(g) + O2(g)的△H=_______kJ/mol,试判断NO(g)常温、常压下能否自发分解 ________填能或不能)。
(2)为防止光化学烟雾,除从工厂、汽车的设计进行改进外,也要采用某些化学方法。用焦炭还原NOx 的反应为2NOx(g) + xC(s)N2(g) + xCO2(g)
Ⅰ.在恒温条件下,2 molNO2(g)和足量 C(s)反应,测得平衡时 NO2(g)和 CO2(g)的物质的量浓度与平衡总压的关系如图所示:
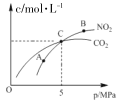
①A、B两点NO2平衡转化率的关系α(A)____α(B),平衡常数关系K(A)_____K(B)(填>、<或=)。
②计算C点时该反应的压强平衡常数Kp=_____MPa(Kp是用平衡分压代替平衡浓度)计算,分压=总压×物质的量分数)。
Ⅱ.现在向容积均为 2L 的两个密闭容器A、B中加入一定量的 NO(g)和足量的C(s),相同温度下测得两容器中n(NO)随时间变化情况如表所示:
0 | 20 | 40 | 60 | 80 | |
n(NO)/mol(A) | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
n(NO)/mol(B) | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
B容器内反应在 100s时达到平衡状态,则0~100s内用 NO 表示的平均反应速率为v(NO)= ____________。
(3)近年来电化学方法在处理氮氧化物方面也起到了一定的作用,如图是一种氨气一二氧化氮燃料电池,常温下可将二氧化氮转化为氮气。

①c口通入的气体为______ ,写出负极反应的方程式 ________。
②若a、d口产生的气体体积共为1.568L(标况下),电路中通过的电子数为____。
