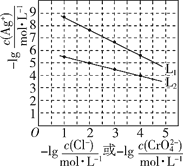
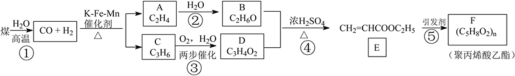
题目内容
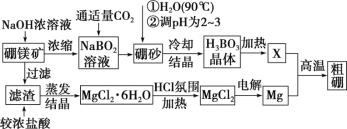
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

(1) 加入试剂B的目的是____________。
(2) 检验硫酸铵中含有铵根离子,常加入_____溶液加热检验,产生的气体常用____检验。
(3) 写出“除杂”反应的离子方程式__________________。
【答案】将硫酸亚铁氧化为硫酸铁 NaOH溶液 湿润的红色石蕊试纸 Ca2++ ![]() =CaSO4
=CaSO4
【解析】
在含有硝酸钙的硫酸亚铁中加入硫酸既能抑制硫酸亚铁水解,有能将硝酸钙转化为硫酸钙,过滤除去,加入H2O2可将二价铁氧化为三价铁,加入硫酸铵形成刘安铁铵,蒸发浓缩,冷却结晶,过滤、干燥过后可得硫酸铁铵晶体据此分析解答。
(1)该流程是以含有硝酸钙的硫酸亚铁制备硫酸铁铵晶体,除杂后要将硫酸亚铁氧化为硫酸铁;
(2)硫酸铵和氢氧化钠在加热的条件下生成氨气,产生的气体常用湿润的红色石蕊试纸检验;
(3) “除杂”反应的离子方程式为:Ca2++![]()
![]() CaSO4。
CaSO4。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目