��Ŀ����
����Ŀ��F��������ϩ�����Ļ��ġ���úΪԭ����ȡF��һ�ֺϳ�·�����£�

(1)���ô���Fe�����ڱ���λ��Ϊ��__________��̬Mnԭ�Ӽ۵��ӵ����Ų�ʽΪ��__________ ��
(2)�ٵļӹ��ֶγ�Ϊú __________(������������Һ��������������)��
(3)�ڡ��ܷ�Ӧ����������________��________��
(4)E������������������________��________��
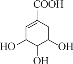
(5)C��A��Ϊͬϵ�C�Ļ�ѧ������________��F�Ľṹ��ʽΪ ________��
(6)��Ӧ�ܵĻ�ѧ����ʽΪ____________��
���𰸡��������ڵ�VIII�� 3d54s2 ���� �ӳɷ�Ӧ ȡ����Ӧ(��������Ӧ) ̼̼˫�� ���� ��ϩ ![]() CH2��CHCOOH+C2H5OH
CH2��CHCOOH+C2H5OH![]() CH2��CHCOOC2H5+H2O
CH2��CHCOOC2H5+H2O
��������
��������ú��ˮ������Ӧ�Ƶ�CO��H2��CO��H2�ڴ������ȵ������ºϳ�A(��ϩ)��C��AΪͬϵ�����CΪ��ϩ����ϩ��ˮ�����ӳɷ�Ӧ����BΪ�Ҵ�����ϩ����������Ӧ�Ƶ�D��D��B����������Ӧ����E������E�Ľṹ��ʽ��֪D�Ľṹ��ʽΪCH2=CHCOOH��E�к���̼̼˫���������Ӿ۷�Ӧ����FΪ![]() ��
��
(1)FeΪ26��Ԫ�أ�λ�ڵ������ڵ�VIII�壻MnԪ��Ϊ25��Ԫ�أ���̬ԭ�Ӻ�������Ų�Ϊ[Ar]3d54s2���۵����Ų�Ϊ3d54s2��
(2)�ٵļӹ��ֶ�ú��������
(3)��Ӧ��Ϊ��ϩ��ˮ�ļӳɷ�Ӧ����Ӧ��Ϊ�Ҵ��ͱ�ϩ���������Ӧ(��ȡ����Ӧ)��
(4)����E�Ľṹ��ʽ��֪�������Ϊ̼̼˫����������
(5)C�ķ���ʽΪC3H6������ϩΪͬϵ�����̼̼˫��������CΪ��ϩ��E�����Ӿ۷�Ӧ����F������FΪ![]() ��
��
(6)��Ӧ��Ϊ�Ҵ��ͱ�ϩ���������Ӧ����ѧ����ʽΪCH2=CHCOOH+C2H5OH![]() CH2=CHCOOC2H5+H2O��
CH2=CHCOOC2H5+H2O��

����Ŀ��I����п��ijŨ�ȵ����ᷴӦ��ʵ���У�ʵ��Ա�õ�����Ľ����
п������(g) | п����״ | �¶�(��) | �ܽ����Ứ��ʱ��(s) | |
A | 2 | ��Ƭ | 5 | 400 |
B | 2 | ��Ƭ | 15 | 200 |
C | 2 | ��Ƭ | 25 | 100 |
D | 2 | ��Ƭ | 35 | 50 |
E | 2 | ��Ƭ | 45 | 25 |
F | 2 | ��ĩ | 15 | 5 |
(1)д����̬Zn2+�ĺ�������Ų�ʽ��_____���÷�Ӧ��_____��Ӧ(��������������������)��
(2)��ϸ�۲�A��F��ʵ�����ݶԱȣ�����Եõ������¶�Ӱ�췴Ӧ���ʽ��ۣ��ô˽��ۣ����㣺55��ʱ��2gп��Ƭ�ܽ��������軨 _____s��
II��ij���淴Ӧ��ij���Ϊ5 L���ܱ������н��У��ڴ�0~4���Ӹ����ʵ����ı仯�����ͼ��ʾ(X
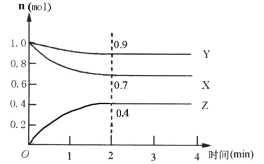
(3)�÷�Ӧ�ĵĻ�ѧ����ʽΪ__________________��
(4)��Ӧ��ʼ��2����ʱ��X��ƽ����Ӧ����Ϊ__��
(5)��˵���÷�Ӧ�Ѵﵽƽ��״̬����_________��
a��ÿ����1molX��ͬʱ����1.33molZ b��������ѹǿ���ֲ���
c��Z��Ũ�Ȳ��ٱ仯 d�������ڻ��������ܶȱ��ֲ���
(6)����ͼ���ƽ��ʱY��ת����Ϊ__________________��
(7)����������������䣬����He�������ڷ�Ӧ���ʽ�_______��(��������������С������������)