题目内容
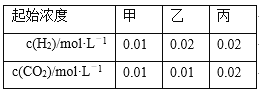
【题目】如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是

A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
【答案】A
【解析】
根据起点的pH=1计算原盐酸的浓度;x对应溶液的pH=7,所以氢氧化钠与盐酸恰好反应;混合后溶液的pH=12,说明氢氧化钠过量,根据![]() 计算需要氢氧化钠溶液的体积。
计算需要氢氧化钠溶液的体积。
起点的pH=1,说明c(H+)=0.1 mol·L-1,盐酸是强酸,所以原盐酸的浓度为0.10 mol·L-1,故A正确;x对应溶液的pH=7,所以氢氧化钠与盐酸恰好反应,所以x=20.0,故B错误;![]() ,V=0.0244L=24.4mL,故C错误;根据A选项,原盐酸的浓度为0.10 mol·L-1,故D错误。
,V=0.0244L=24.4mL,故C错误;根据A选项,原盐酸的浓度为0.10 mol·L-1,故D错误。

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目