题目内容
【题目】常温下,某浓度H2A溶液中滴加NaOH溶液,若定义pC=﹣lgC,则测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是( )
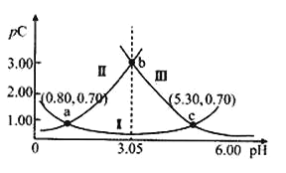
A.曲线II表示pC(HA-)随pH的变化
B.常温下,![]() =104.50
=104.50
C.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
D.a、b、c三点对应的溶液,c(HA-)+c(A2-)+c(HA)始终不变
【答案】B
【解析】
(1)Pc随着pH的变化而变化,说明溶液中存在![]() 和
和![]() ,H2A是一元弱酸;
,H2A是一元弱酸;
(2)pH越大,c(H+)越小,平衡右移程度越大,c(A2-)越大,pc(A2-)越小,所以Ⅲ是pc(A2-),pH越小,c(H+)越大,平衡左移程度越大,c(H2A)越大,pc(H2A)越小,所以Ⅱ是pc(H2A)和pH的关系曲线,Ⅰ是pc(HA-)和pH的关系曲线;
(3)Ka1=![]() ,用a点计算Ka1=c(H+)=10-0.8,Ka2=
,用a点计算Ka1=c(H+)=10-0.8,Ka2=![]() ,用c点计算Ka2=c(H+)=10-5.3。
,用c点计算Ka2=c(H+)=10-5.3。
A.由分析可知,曲线II表示pc(H2A)随pH的变化,A错;
B.Ka1=![]() =,Ka2=
=,Ka2=![]() ,
,![]() =
=![]() =
=![]() =104.50,B正确;
=104.50,B正确;
C.![]() ,用b点计算Kh1=
,用b点计算Kh1=![]() =10-3.05,由分析可知Ka1=10-0.8,所以Ka1>Kh1,所以将等浓度等体积的Na2A与H2A溶液混合后,溶液显酸性,C错误;
=10-3.05,由分析可知Ka1=10-0.8,所以Ka1>Kh1,所以将等浓度等体积的Na2A与H2A溶液混合后,溶液显酸性,C错误;
D.根据物料守恒,a、b、c三点对应的溶液,n(H2A)+n(HA﹣)+n(A2﹣)始终不变,但溶液体积改变,所以浓度之和发生改变,D错误。
答案选B。

【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的合成路线如图所示,回答下列问题。
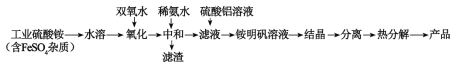
(1)“氧化”步骤发生的离子方程式为:___,使用双氧水作氧化剂优点为___:
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为___。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=![]() ×100%)如表所示:
×100%)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在温度区间___铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是___。
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是___。
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=___(保留一位小数,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。