题目内容
可逆反应aX(g)+bY(g)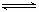 cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是 
| A.若a+b=c,则t0时只能是增大了容器的压强 |
| B.若a+b=c,则t0时只能是加入了催化剂 |
| C.若a+b≠c,则t0时只能是加入了催化剂 |
| D.若a+b≠c,则t0时只能是增大了容器的压强 |
C
解析试题分析:若a+b=c,反应前后气体的物质的量不变,增大压强,正、逆反应速率同等倍数的增大,化学平衡不移动,使用催化剂也是同等倍数的增大正、逆反应速率,都符合图像;若a+b≠c,增大压强,平衡向气体体积减小的方向移动,化学平衡移动,只有加入催化剂才符合图像,故C项正确。
考点:本题考查化学速率图像的分析、外界条件对化学反应速率和化学平衡的影响。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
反应P(g)+Q(g) M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
M(g)+N(s) ΔH<0,达到平衡时,下列说法正确的是
| A.减小容器体积,平衡不移动 | B.加入催化剂,M的产率增大 |
| C.增大c(P),P的转化率增大 | D.降低温度,Q的转化率增大 |
已知反应2CH3OH(g) CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。此温度下,在体积恒定的密闭容器中加入一定量的CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是
A.该反应的平衡常数表达式为K=[c(CH3OCH3)×c(H2O)]/c(CH3OH)
B.此时正、逆反应速率的大小:υ正<υ逆
C.若经10min后反应达到平衡,此时c(CH3OH)=0.04mol/( L·min)
D.0~10min内平均反应速率υ(CH3OH)=1.6mol/(L·min)
下列事实不能用勒夏特列原理解释的是( )
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
C.对2NO2(g)  N2O4(g), 升高温度平衡体系颜色变深 N2O4(g), 升高温度平衡体系颜色变深 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
下列图示与对应的叙述相符的是( )。
A.图1表示可逆反应 温度 温度 的情形 的情形 |
B.图2表示压强对可逆反应 的影响,乙的压强比甲的压强大 的影响,乙的压强比甲的压强大 |
| C.图3中a、b、c三点中只有b点已经达到化学平衡状态 |
| D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线 |
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s) 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
| | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | .0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol? L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
A.平衡常数K= |
| B.该反应在T1时的平衡常数比T2时的小 |
| C.任意时刻,T2温度下的反应速率均大于T1温度下的速率 |
D.处于A点的反应体系从T1变到T2,达到平衡时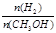 增大 增大 |
 2SO3并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
2SO3并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是