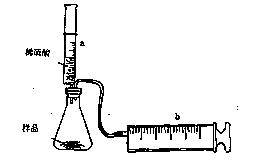
题目内容
欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:
①反应中除生成NO2气体外还会有少量的NO生成;
②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。
为完成测定并验证有NO生成,有人没计如F实验装置:

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 。
(2)装置中B瓶的作用是 。
(3)实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是 ;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入____(填“冷”或“热”)的氧气,其原因是:____
(4)若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需加入过量的____(填一种物质的化学式,下同)溶液,过滤、洗涤、干燥称量 的质量就可达目的。(已知Cu(OH)2与AgOH类似,也可以溶于过量的氨水而形成溶液。)
①反应中除生成NO2气体外还会有少量的NO生成;
②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。
为完成测定并验证有NO生成,有人没计如F实验装置:

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 。
(2)装置中B瓶的作用是 。
(3)实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是 ;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入____(填“冷”或“热”)的氧气,其原因是:____
(4)若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需加入过量的____(填一种物质的化学式,下同)溶液,过滤、洗涤、干燥称量 的质量就可达目的。(已知Cu(OH)2与AgOH类似,也可以溶于过量的氨水而形成溶液。)

略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
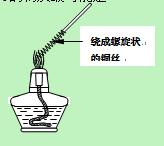

 __ (填写字母编号,有几个写几个,多写或写错0分)。
__ (填写字母编号,有几个写几个,多写或写错0分)。 了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。
了钝化,若铁棒表面________,则铁和浓硫酸未发生反应。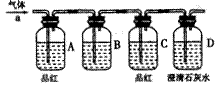
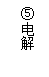
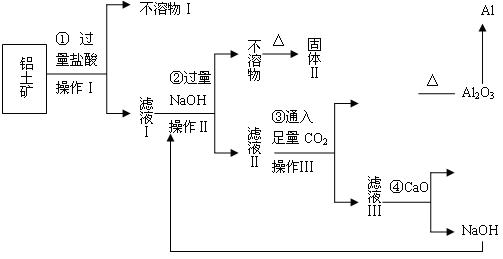
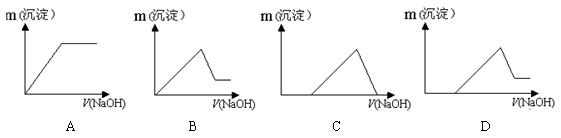
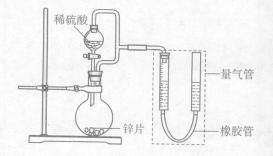
 。
。