题目内容
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
表二 FeSO4和Al2(SO4)3在水中的溶解度
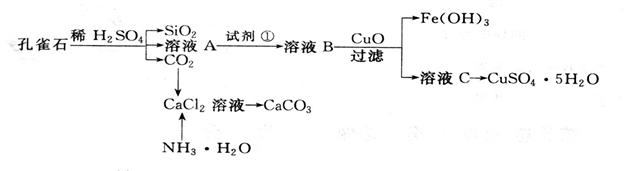
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后, ,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式 。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是 。
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后, ,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式 。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是 。
(1)① 洗去油污 (1分) ③ 在②的滤液中加入稍过量的洗涤过的废铁屑(1分),
充分反应后过滤(1分)
④ 将③的滤渣溶入足量的稀硫酸(1分),过滤,滤液保留待用(1分)
(2)⑤③ (2分)将溶液加热(温度不超过80℃)蒸发浓缩(1分),冷却结晶(1分)
(3)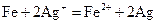 ,
,  ,
,
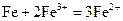 ,
,  (4分)
(4分)
(4)抑制 的水解(防止
的水解(防止 被氧化)(2分)
被氧化)(2分)
充分反应后过滤(1分)
④ 将③的滤渣溶入足量的稀硫酸(1分),过滤,滤液保留待用(1分)
(2)⑤③ (2分)将溶液加热(温度不超过80℃)蒸发浓缩(1分),冷却结晶(1分)
(3)
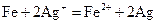 ,
,  ,
,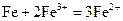 ,
,  (4分)
(4分)(4)抑制
 的水解(防止
的水解(防止 被氧化)(2分)
被氧化)(2分)略

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
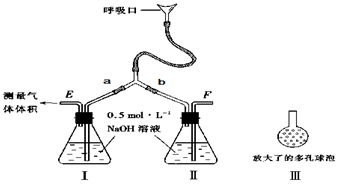

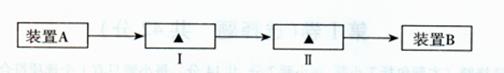
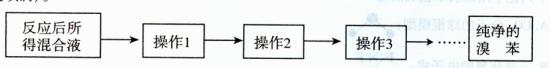
 。操作2目的: 。
。操作2目的: 。