题目内容
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____________; lmol O22+中含有的π键数目为_______________。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为_________。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是___________________;分子中处于同一直线上的原子数目最多为_______________。
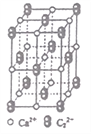
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为______。 CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的C22-数目为_________________。
【答案】 ![]() 2NA 1s22s22p63s23p63d10 sp杂化 sp2杂化 3 8 4
2NA 1s22s22p63s23p63d10 sp杂化 sp2杂化 3 8 4
【解析】(1)等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键;(2)Cu为29号元素,得出Cu+的基态电子排布式为;(3)丙烯腈(H2C=CH-C≡N)中的C分别形成2个![]() 键和3个
键和3个![]() 键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;(4)根据均摊法分析晶体结构。
键,故碳原子的杂化轨道类型为sp和sp2杂化,与sp杂化的C原子直接相连的原子有C和N,故同在一条直线上有3个原子;(4)根据均摊法分析晶体结构。
(1)由C22-电子式为[∶CC∶]2-可推知O22+电子式为[∶OO∶]2+,氧氧三键中含两个π键,1 mol O22+中含有π键数目为2NA。
(2)Cu+由Cu原子失去1个电子而得到,故基态核外电子排布式为1s22s22p63s23p63d10。
(3)丙烯腈分子中碳碳双键为sp2杂化,—C≡N键为sp杂化,其分子中有一个三键,故共键的原子为C-C≡N即3个原子共线。因此,本题正确答案为:sp杂化 ;sp2杂化; 3
(4)由晶胞图知C22-位于面心和顶点,根据均摊法,晶胞中的碳原子个数为=2×(8×![]() +6×
+6×![]() )=8;由晶体结构可知CaC2晶体中1个Ca2+周围距离最近的C22-数目不是6个而是4个,因为哑铃形C22-只向一个方向拉长,此方向上的两个C22-与Ca2+距离不是最近,所以最近且等距的有4个。因此,本题正确答案为:8 ;4。
)=8;由晶体结构可知CaC2晶体中1个Ca2+周围距离最近的C22-数目不是6个而是4个,因为哑铃形C22-只向一个方向拉长,此方向上的两个C22-与Ca2+距离不是最近,所以最近且等距的有4个。因此,本题正确答案为:8 ;4。

 优等生题库系列答案
优等生题库系列答案【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
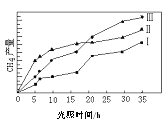
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
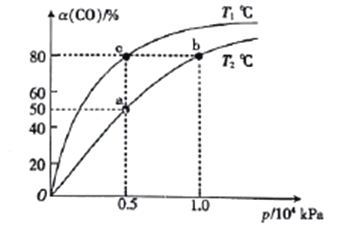
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
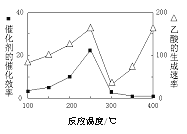
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。