题目内容
【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
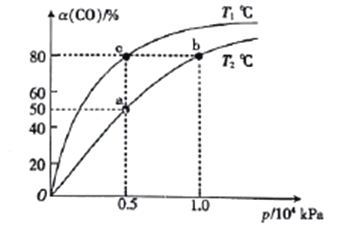
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。

则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
【答案】 C2H5OH(g)+3O2(g) 2CO2(g)+3H2O(g) △H=-1253 kJmol-1 > < 温度低于240℃时,反应速率较慢,同时该反应为放热反应,温度高于270℃时,化学平衡逆向移动,转化率降低 K(a)=K(b)<K(c) < 由图可知,随着温度升高,K1减小,则△H1<0,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3
【解析】(1)已知反应 C2H5OH(g)+3O2(g)![]() 2CO2(g)+3H2O(g) 的△H=反应物的键能和-生成物的键能和=(413×5+348×1+351×1+463×1+498×3) kJmol-1 -(799×4+463×6) kJmol-1=-1253 kJmol-1,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为C2H5OH(g)+3O2(g)
2CO2(g)+3H2O(g) 的△H=反应物的键能和-生成物的键能和=(413×5+348×1+351×1+463×1+498×3) kJmol-1 -(799×4+463×6) kJmol-1=-1253 kJmol-1,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为C2H5OH(g)+3O2(g)![]() 2CO2(g)+3H2O(g) △H=-1253 kJmol-1 ;
2CO2(g)+3H2O(g) △H=-1253 kJmol-1 ;
(2)①温度相同时,压强越大反应速率越快,则a、b两点的反位速率:v(b)>v(a);
②压强相同时,温度越高达到平衡所需要的时间越短,则T1<T2;
③温度低于240℃时,反应速率较慢,同时该反应为放热反应,温度高于270℃时,化学平衡逆向移动,转化率降低,再结合催化剂活性,比反应的温度一般控制在240~270℃;
④图中a、b两点温度不变,平衡常数不变,即K(a)=K(b),升高温度平衡逆向移动,平衡常数减小,则K(a)=K(b)<K(c);
(3)由图可知,随着温度升高,K1减小,则△H1<0,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案