��Ŀ����
����Ŀ����һ��������Mg-Al�Ͻ�Ͷ��100mLһ�����ʵ���Ũ�ȵ�ijHCl��Һ�У���ַ�Ӧ����Ӧ�����Һ����μ���һ�����ʵ���Ũ�ȵ�NaOH��Һ�����ɳ���������������NaOH��Һ�������ϵ����ͼ���ش��������⣺

��1��д��OA�κ�BC�η�Ӧ�����ӷ���ʽ��
OA��___________ �� BC��_____________��
��2��ԭMg-Al�Ͻ��������_____________��
��3��ԭHCl��Һ�����ʵ���Ũ����________________��
��4������NaOH��Һ�����ʵ���Ũ����____________��
���𰸡�H++OH-=H2O�� Al(OH)3+OH-=AlO2-+2H2O 5.1g 6mol/L 5mol/L
��������
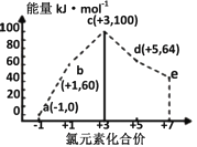
������Ҫ���������仯���
Mg-Al�Ͻ���HCl��Һ��Ӧ������MgCl2��AlCl3��MgCl2��NaOH��Ӧ����Mg(OH)2������AlCl3��NaOH��Ӧ����Al(OH)3������NaOH����ʱ��Al(OH)3������NaOH��Һ��Ӧ����NaAlO2��Һ����ͼ��֪����ʼ����NaOH��Һʱ������������˵��Mg-Al�Ͻ���HCl��Һ��Ӧ��HCl��ʣ�࣬��OA�η���NaOH��HCl������кͷ�Ӧ��AB�η���������Ӧ����Mg(OH)2��Al(OH)3������BC�γ������������٣�����Al(OH)3�����ܽⷴӦ����NaAlO2�����ճ���ΪMg(OH)2��
��1�����ݷ�����֪OA�ε����ӷ���ʽΪ��H++OH-=H2O��BC�ε����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O��
��2�����ݷ���C����ڳ���ΪMg(OH)2������Ϊ5.8g������þԪ���غ㣬�� Mg�����ʵ���Ϊn(Mg)=n[Mg(OH)2]=0.1mol������B�����������Ϊ13.6g��C���������Ϊ5.8g����B�����ɵ�Al(OH)3����������Ϊ7.8g��������Ԫ���غ㣬��Al�����ʵ���Ϊn(Al)=n[Al(OH)3]=0.1mol����ԭMg-Al�Ͻ������Ϊ0.1mol��24g/mol+0.1mol��27g/mol=5.1g��
��3��BC�η�����ӦAl(OH)3+OH-=AlO2-+2H2O��0.1mol Al(OH)3����NaOH�����ʵ���Ϊ0.1mol����Һ���Ϊ20mL����NaOH��Һ�����ʵ���Ũ��Ϊ0.1mol/0.02L=5mol/L��B������NaOH�����ʵ���Ϊ0.12L��5mol/L=0.6mol��B����Һ������ΪNaCl��������Ԫ���غ㣬��ԭ�����к���HCl�����ʵ���Ϊ0.6mol����ԭHCl��Һ�����ʵ���Ũ��Ϊ0.6mol/0.1L=6mol/L��
��4�����ݣ�3���з�����֪NaOH��Һ�����ʵ���Ũ��Ϊ5mol/L���ݴ˽��
Mg-Al�Ͻ���HCl��Һ��Ӧ������MgCl2��AlCl3��MgCl2��NaOH��Ӧ����Mg(OH)2������AlCl3��NaOH��Ӧ����Al(OH)3������NaOH����ʱ��Al(OH)3������NaOH��Һ��Ӧ����NaAlO2��Һ����ͼ��֪����ʼ����NaOH��Һʱ������������˵��Mg-Al�Ͻ���HCl��Һ��Ӧ��HCl��ʣ�࣬��OA�η���NaOH��HCl������кͷ�Ӧ��AB�η���������Ӧ����Mg(OH)2��Al(OH)3������BC�γ������������٣�����Al(OH)3�����ܽⷴӦ����NaAlO2�����ճ���ΪMg(OH)2��
��1�����ݷ�����֪OA�ε����ӷ���ʽΪ��H++OH-=H2O��BC�ε����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O����С���Ϊ��H++OH-=H2O��Al(OH)3+OH-=AlO2-+2H2O��
��2�����ݷ���C����ڳ���ΪMg(OH)2������Ϊ5.8g������þԪ���غ㣬�� Mg�����ʵ���Ϊn(Mg)=n[Mg(OH)2]=0.1mol������B�����������Ϊ13.6g��C���������Ϊ5.8g����B�����ɵ�Al(OH)3����������Ϊ7.8g��������Ԫ���غ㣬��Al�����ʵ���Ϊn(Al)=n[Al(OH)3]=0.1mol����ԭMg-Al�Ͻ������Ϊ0.1mol��24g/mol+0.1mol��27g/mol=5.1g����С���Ϊ��5.1g��
��3��BC�η�����ӦAl(OH)3+OH-=AlO2-+2H2O��0.1mol Al(OH)3����NaOH�����ʵ���Ϊ0.1mol����Һ���Ϊ20mL����NaOH��Һ�����ʵ���Ũ��Ϊ0.1mol/0.02L=5mol/L��B������NaOH�����ʵ���Ϊ0.12L��5mol/L=0.6mol��B����Һ������ΪNaCl��������Ԫ���غ㣬��ԭ�����к���HCl�����ʵ���Ϊ0.6mol����ԭHCl��Һ�����ʵ���Ũ��Ϊ0.6mol/0.1L=6mol/L����С���Ϊ��6mol/L��
��4�����ݣ�3���з�����֪NaOH��Һ�����ʵ���Ũ��Ϊ5mol/L��

 ͬ����ϰǿ����չϵ�д�
ͬ����ϰǿ����չϵ�д�