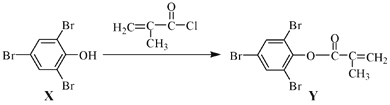
题目内容
【题目】硫酸铜晶体常用做农业和渔业的杀虫剂、杀菌剂。实验室模拟由废铜屑(含少量铁)生产硫酸铜晶体的流程如图:
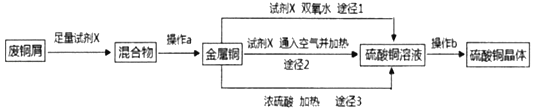
(1)试剂X是_____,操作a需要的玻璃仪器有烧杯、玻璃棒和_____。
(2)途径1是将铜加入到试剂X与双氧水的混和液中并用30~40℃水浴加热,该过程中温度不宜过高的原因是_____。
(3)途径2是将铜加入到试剂X中,再通入足量的空气并加热,该反应的化学方程式为_____。
(4)从环保和经济的角度对比途径1与途径3,途径1的优点有_____、_____。
(5)操作b包括蒸发浓缩、_____、过滤、冼涤、干燥(请补全缺少的实验步骤)。
(6)硫酸铜晶体(CuSO4xH2O)中结晶水数目可通过以下实验测定:
Ⅰ.称取4.6400g样品置于小烧杯中,加入适量水溶解,边搅拌边滴加BaCl2溶液到沉淀完全
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为4.6600g。计算CuSO4xH2O中的x值(要求写出计算过程)_____。
【答案】稀硫酸 漏斗 温度过高双氧水会分解 2Cu+O2+2H2SO4=2CuSO4+2H2O 产物无污染; 原子利用率高 冷却结晶 4
【解析】
向废铜屑(含少量铁)中加入稀硫酸除去Fe,过滤得到纯Cu,途径1:Cu+H2O2+H2SO4=CuSO4+2H2O;途径2:2Cu+O2+2H2SO4=2CuSO4+2H2O;途径3:Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,得到CuSO4溶液,从溶液中蒸发浓缩、冷却结晶、过滤得到胆矾晶体,冼涤、干燥得到纯净的胆矾晶体,则试剂X是稀硫酸,操作a是过滤,
CuSO4+SO2↑+2H2O,得到CuSO4溶液,从溶液中蒸发浓缩、冷却结晶、过滤得到胆矾晶体,冼涤、干燥得到纯净的胆矾晶体,则试剂X是稀硫酸,操作a是过滤,
(1)由上述分析可知,试剂X是稀硫酸,操作a是过滤,过滤需要的玻璃仪器为烧杯、玻璃棒、漏斗,
故答案为:稀硫酸;漏斗;
(2)双氧水受热易分解,控制水浴加热温度为30~40℃,目的是防止温度过高导致双氧水发生分解,
故答案为:温度过高双氧水会分解;
(3)Cu、稀H2SO4、O2三者发生反应生成CuSO4和H2O,反应的化学方程式为2Cu+O2+2H2SO4=2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4=2CuSO4+2H2O;
(4)途径1反应为Cu+H2O2+H2SO4=CuSO4+2H2O,途径3反应为Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,途径3中生成污染性气体SO2,生成等量的CuSO4时,途径3消耗H2SO4的量为途径1的2倍,即途径1原子利用率高,途径1的优点有:产物无污染,原子利用率高,
CuSO4+SO2↑+2H2O,途径3中生成污染性气体SO2,生成等量的CuSO4时,途径3消耗H2SO4的量为途径1的2倍,即途径1原子利用率高,途径1的优点有:产物无污染,原子利用率高,
故答案为:产物无污染;原子利用率高;
(5)从溶液中结晶得到含有结晶水的胆矾晶体的方法为蒸发浓缩、冷却结晶,再经过过滤、冼涤、干燥得到纯净胆矾晶体,
故答案为:冷却结晶;
(6)4.6400g样品中CuSO4~BaSO4,n(CuSO4)=n(BaSO4)=0.02mol,m(CuSO4)=nM=3.2g,m(H2O)=4.64g﹣3.2g=1.44g,n(H2O)=![]() =0.08mol,x=
=0.08mol,x=![]() =
=![]() =4,
=4,
故答案为:4。