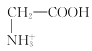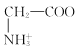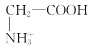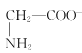题目内容
【题目】下列过程表达式中,属于电离方程式的是( )
A. HSO3-+H3O+![]() H2SO3+H2OB. NH3·H2O
H2SO3+H2OB. NH3·H2O![]() NH4++OH-
NH4++OH-
C. CH3COO-+H2O![]() CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
CH3COOH+OH-D. HCO3-+OH-=H2O+CO32-
【答案】B
【解析】
酸、碱、盐溶于水时发生电离,此过程用电离方程式表示,书写电离方程式时应先判断电解质的强弱。如为强电解质则在水中完全电离,用“=”连接,若为弱电解质则在水中部分电离,用“![]() ”连接。同时等式两边应遵循质量守恒定律,即左右两边同种元素的原子个数相等。溶液之所以不显电性,是因为阳离子所带的正电总数和阴离子所带的负电荷总数相等,电离时原子团一般不拆分。
”连接。同时等式两边应遵循质量守恒定律,即左右两边同种元素的原子个数相等。溶液之所以不显电性,是因为阳离子所带的正电总数和阴离子所带的负电荷总数相等,电离时原子团一般不拆分。
A. HSO3-+H3O+![]() H2SO3+H2O,此式可表示为HSO3-+H+
H2SO3+H2O,此式可表示为HSO3-+H+![]() H2SO3,不是电离方程式,A项错误;
H2SO3,不是电离方程式,A项错误;
B. NH3·H2O![]() NH4++OH-,表示NH3·H2O 为弱电解质,发生部分电离,B项正确;
NH4++OH-,表示NH3·H2O 为弱电解质,发生部分电离,B项正确;
C. CH3COO-+H2O![]() CH3COOH+OH-,表示CH3COO-在水中发生水解反应,不是电离方程式,C项错误;
CH3COOH+OH-,表示CH3COO-在水中发生水解反应,不是电离方程式,C项错误;
D. HCO3-+OH-=H2O+CO32-,表示酸式盐与碱反应生成正盐和水,不是电离方程式,D项错误;
答案应选B。

练习册系列答案
相关题目