题目内容
【题目】如图为一个电解装置,该装置中X、Y分别为石墨电极,现分别在U型管中加入下列溶液进行电解,请回答有关问题:
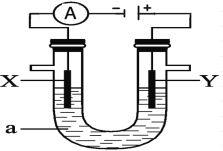
(1)若U型管中的液体a为饱和食盐水:在电极Y上产生的气体是_________ (填分子式),检验有该气体生成的简单方法是________________________;若该饱和食盐水中还含有少量的镁离子,则有可能在______极(选填“X”或“Y”)附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,能收集到标准状况下的氢气 ______升;工厂应用电解生成的氯气和氢气可以化合生成氯化氢,某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸__________ t。(保留至整数)
(2)若U型管中的液体a为饱和氯化铜溶液:电极质量增加的是_______选填“X”或“Y”)极,该电极上发生______反应(选填“氧化”或“还原”);若要得到0.32克铜,理论上在电解过程中应转移_________mol电子;氯化铜溶液显酸性,原因是(用离子方程式表示)_______________________________;电解一段时间后,请你推测:整个溶液的酸性将如何变化(增强、减弱、不变,同时请写出理由:_______
【答案】Cl2 湿润的淀粉碘化钾试纸变蓝 X 22.4L 644 X 还原 0.01mol Cu2++2H2O![]() Cu(OH)2+2H+ 铜离子浓度减小,水解程度减弱,酸性减弱
Cu(OH)2+2H+ 铜离子浓度减小,水解程度减弱,酸性减弱
【解析】
(1)若U型管中的液体a为饱和食盐水,则该装置是电解饱和食盐水的装置,根据相关知识回答问题;
(2) 若U型管中的液体a为饱和氯化铜溶液,则该装置是电解饱和氯化铜的装置,根据相关知识回答问题。
(1)若U型管中的液体a为饱和食盐水,Y与电源正极相连为阳极,阳极反应为2Cl--2e-=Cl2↑,产生的气体是Cl2;检验氯气的方法是:湿润的淀粉碘化钾试纸变蓝;X为阴极,阴极反应为2H++2e-=H2↑,阴极附近会产生氢氧根,生成白色的氢氧化镁沉淀,故在X极附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,同时消耗0.2mol H+,生成0.1mol氢气,标况下的体积为0.1mol![]() 22.4L/mol=2.24L;电解氯化钠溶液的原理方程式为:2NaCl+2H2O
22.4L/mol=2.24L;电解氯化钠溶液的原理方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,电解400 t食盐,则生成氯气物质的量为
Cl2↑+H2↑+2NaOH,电解400 t食盐,则生成氯气物质的量为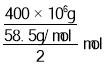 =3.42
=3.42![]() mol,氯气80%用于生产盐酸,可得到质量分数为31%的盐酸为
mol,氯气80%用于生产盐酸,可得到质量分数为31%的盐酸为![]() =644t;
=644t;
(2)电解氯化铜溶液时,X作为阴极,发生反应:Cu + 2e = Cu,质量增加;该电极得电子,发生还原反应;生成1mol铜转移2mol电子,若要得到0.32克铜,需要转移![]() =0.01mol;氯化铜溶液显酸性的原因是铜离子发生了水解,离子方程式为:Cu2++2H2O
=0.01mol;氯化铜溶液显酸性的原因是铜离子发生了水解,离子方程式为:Cu2++2H2O![]() Cu(OH)2+2H+;电解氯化铜溶液的总方程式为:CuCl2
Cu(OH)2+2H+;电解氯化铜溶液的总方程式为:CuCl2 ![]() Cu + Cl2
Cu + Cl2![]() ,电解一段时间后,铜离子浓度减小,水解程度减弱,酸性减弱。
,电解一段时间后,铜离子浓度减小,水解程度减弱,酸性减弱。

 阅读快车系列答案
阅读快车系列答案【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如图:
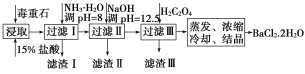
(1)毒重石用盐酸浸取前需充分研磨,目的是__。
(2)加入NH3·H2O调pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。加入H2C2O4时应避免过量,原因是__。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的__(填“上方”或“下方”)。BaCl2溶液的浓度为__mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将__(填“偏大”或“偏小”)。
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小