题目内容
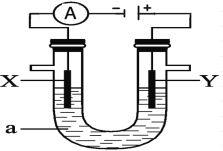
【题目】液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。下列说法不正确的是
已知:①Zn(OH)2+2OH == Zn(OH)42 。 ②KOH凝胶中允许离子存在、生成或迁移。
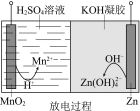
A.放电过程中,H+由正极向负极迁移
B.放电过程中,正极的电极反应:MnO2+4H++2e== Mn2++2H2O
C.充电过程中,阴极的电极反应:Zn(OH)42+2e == Zn+4OH
D.充电过程中,凝胶中的KOH可再生
【答案】A
【解析】
放电过程中,Zn为负极,电极反应式为: Zn -2e+4OH == Zn(OH)42,MnO2为正极,电极反应式为:MnO2+4H++2e== Mn2++2H2O,充电时的阴极反应式为:Zn(OH)42+2e == Zn +4OH,阳极反应式为: Mn2++2H2O-2e== MnO2+4H+。
A、放电时正极反应式为:MnO2+4H++2e== Mn2++2H2O,消耗氢离子,应该是硫酸根离子向锌电极迁移,故A错误;
B、MnO2为正极,电极反应式为:MnO2+4H++2e== Mn2++2H2O,故B正确;
C、充电时,由负极反应式写阴极反应式为:Zn(OH)42+2e == Zn+4OH,故C正确;
D、充电过程中,阴极反应式为:Zn(OH)42+2e == Zn +4OH,氢氧根与钾离子组成氢氧化钾,故D正确。
答案选A。

【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
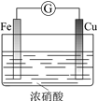
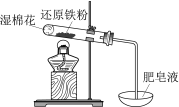
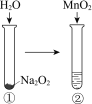
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D