题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,11.2L氯仿(CHCl3)中含有的C-Cl键的数目为1.5NA |
| B.1mol氯气和足量的铁反应转移电子数为2NA |
| C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| D.10L 0.1mol·L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
B
解析试题分析:A、标准状况下,氯仿不是气体,不能适用于气体摩尔体积,即11.2L氯仿的物质的量不是0.5mol,A不正确;B、氯气与铁的反应中得到2个电子,是以1mol氯气和足量的铁反应转移电子数为2NA,B正确;C、氨气与氯化氢混合后生成固体氯化铵,因此将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积不是22.4L,C不正确;D、碳酸钠溶于水,CO32-水解,因此10L 0.1mol·L-1的Na2CO3溶液中,Na+、CO32-总数小于3NA,D不正确,答案选B。
考点:考查阿伏加德罗常数的计算

练习册系列答案
相关题目
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
| A.水的沸点;水分子的数目 | B.水的密度;水的摩尔质量 |
| C.水的体积;水中所含原子的数目 | D.水的质量;水的相对分子质量 |
下列有关化学用语使用正确的是
A.CO2的电子式: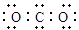 |
| B.次氯酸的结构式:H—O—Cl |
C.中子数为18的氯原子结构示意图: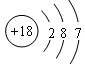 |
| D.二氧化硅的分子式为:SiO2 |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
| A.若M(甲)>M(乙),则气体体积:甲<乙 |
| B.若M(甲)<M(乙),则气体的压强:甲>乙 |
| C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙 |
| D.若M(甲)<M(乙),则的分子数:甲<乙 |
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为0.1 NA |
| B.标准状况下,22.4L甲苯中含C—H数目为8 NA |
| C.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA |
| D.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2 NA |
PM2.5是指直径小于等于2.5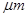 是悬浮颗粒物,其主要来源为燃煤、机动车尾气等。某实验小组将PM2.5样本用蒸馏水处理制成待测试样。测得该试样呈酸性,其各离子浓度如下表,根据表中数据可知该溶液PH为
是悬浮颗粒物,其主要来源为燃煤、机动车尾气等。某实验小组将PM2.5样本用蒸馏水处理制成待测试样。测得该试样呈酸性,其各离子浓度如下表,根据表中数据可知该溶液PH为
| 离子 | K+ | Na+ | NH4十 | 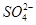 | 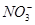 | C1— |
| 浓度/mol.L—1 | 4×l0—6 | 6×l0—6 | 2×l0—5 | 4×l0—5 | 3×l0—5 | 2×l0—5 |
A.2 B.4 C.1 D.6
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为
| A.3:4:1 | B.3:3:2 | C.6:7:3 | D.6:9:0 |