题目内容
PM2.5是指直径小于等于2.5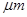 是悬浮颗粒物,其主要来源为燃煤、机动车尾气等。某实验小组将PM2.5样本用蒸馏水处理制成待测试样。测得该试样呈酸性,其各离子浓度如下表,根据表中数据可知该溶液PH为
是悬浮颗粒物,其主要来源为燃煤、机动车尾气等。某实验小组将PM2.5样本用蒸馏水处理制成待测试样。测得该试样呈酸性,其各离子浓度如下表,根据表中数据可知该溶液PH为
| 离子 | K+ | Na+ | NH4十 | 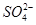 | 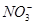 | C1— |
| 浓度/mol.L—1 | 4×l0—6 | 6×l0—6 | 2×l0—5 | 4×l0—5 | 3×l0—5 | 2×l0—5 |
A.2 B.4 C.1 D.6
B
解析试题分析:根据电荷守恒,c(H+)= [c(Cl-)+c(NO3-)+2c(SO42-)]-[c(K+)+c(Na+)+c(NH4+)]=l0—4mol.L—1,pH=4
考点:考查溶液中离子浓度的计算有关问题。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA代表阿伏加德罗常数。下列有关叙述正确的是
| A.标准状况下,2.24 L H2O含有的分子数大于0.1NA |
| B.常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数小于0.1NA |
| C.分子数为NA的C2H4气体体积约为22.4 L |
| D.1.7 g NH3中含N—H键数目为0.1NA |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,11.2L氯仿(CHCl3)中含有的C-Cl键的数目为1.5NA |
| B.1mol氯气和足量的铁反应转移电子数为2NA |
| C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| D.10L 0.1mol·L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
NA代表阿伏加德罗常数,下列说法正确的是
| A.9 g D2O中含有的电子数为5 NA |
| B.46 g NO2和N2O4混合气体中含有原子数为3 NA |
| C.1 mol C2H6分子中共价键总数为8 NA |
| D.7.1 g C12与足量NaOH溶液反应转移的电子数为0.2 NA |
NA表示阿伏加德罗常数,以下各物质所含分子数最多的是( )
| A.标准状况下11.2 L氯气 | B.17g氨气 |
| C.0.8mol氧气 | D.4℃时,36mL的H2O |
向三份同浓度的25mL盐酸中分别加入质量不等的NaHCO3、KHCO3的混合物,测得产生
气体的体积如下表所示(不考虑气体溶解)
| 编号 | 1 | 2 | 3 |
| m(混合物)/g | 4.6 | 7.2 | 7.9 |
| V(CO2)(标准状况)/L | 1.12 | 1.68 | 1.68 |
下列分析推理正确的是
A.根据实验1中的数据可以计算出盐酸的浓度
B.混合物中NaHCO3的质量分数约为45.7%
C.根据第2、3组数据可以分析出第2组中的混合物完全反应
D.盐酸的物质的量浓度为1.5mol.L-1
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| B.78 g 苯含有C="C" 双键的数目为3NA |
| C.1 L 1 mol·L-1的NaClO 溶液中含有ClO-的数目为NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是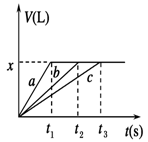
| A.x=2.24 |
| B.钠的物质的量为0.2 mol |
| C.反应时,Na、Mg、Al均过量 |
| D.曲线b为Mg与盐酸反应的图像 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1molFe与过量的稀HNO3反应,转移2 NA个电子 |
| C.1mol/L NaCl溶液含有NA个Na+ |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2 NA个O原子 |