题目内容
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
| A.体积相等时密度相等 | B.原子数相等时具有的中子数相等 |
| C.体积相等时具有的电子数相等 | D.质量相等时具有的质子数相等 |
C
解析试题分析:A同温同压下的两种气体密度比等于它们的相对分子质量之比,错误。B它们都是双原子分子,每摩尔的12C18O和14N2中含中子分别是16摩尔、14摩尔,错误。C同温同压下的体积相等的气体,分子数相等,而每个分子含有14个电子,故电子数相等,正确。D二者的摩尔质量不同,相等质量时的物质的量不同,质子数也就不同,错误。
考点:考查相同条件下关于气体中的质子、中子、电子等的计算及密度大小等知识。

练习册系列答案
相关题目
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是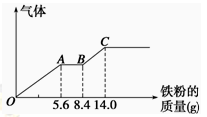
| A.原混合酸中NO3-物质的量为0.1 mol |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.H2SO4浓度为2.5 mol·L-1 |
下列化学用语书写正确的是( )
A.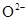 的离子结构示意图: 的离子结构示意图: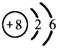 |
B.CH4分子的比例模型: |
C.四氯化碳的电子式: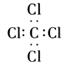 |
D.用电子式表示氯化氢分子的形成过程: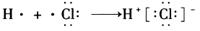 |
若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
| A.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
| B.1.6gNH2-离子所含质子数为NA |
| C.50mL18.4mol·L—1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
| B.在同温同压下,相同体积的任何气体单质所含的原子数目相同 |
| C.14 g乙烯和丙烯的混合物中总原子数为3NA个 |
| D.含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,一定能产生NA个SO2气体分子 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,11.2L氯仿(CHCl3)中含有的C-Cl键的数目为1.5NA |
| B.1mol氯气和足量的铁反应转移电子数为2NA |
| C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L |
| D.10L 0.1mol·L-1的Na2CO3溶液中,Na+、CO32-总数为3NA |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L水中所含电子总数为NA |
| B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA |
| C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
NA表示阿伏加德罗常数,以下各物质所含分子数最多的是( )
| A.标准状况下11.2 L氯气 | B.17g氨气 |
| C.0.8mol氧气 | D.4℃时,36mL的H2O |
Ⅰ、甲同学欲配制0.55 mo1·L—1 的NaOH溶液200mL(存在200mL容量瓶)。称量操作如下:
①先用托盘天平称量烧杯的质量。称量前先调节天平零点。用“↓”表示在天平右盘上放置砝码,用“↑”表示从天平右盘上取下砝码。取用砝码情况和游码读数如下:
| 砝码质量 | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 | 先↓后↑ | ↓ | 先↓后↑ | ↓ | 先↓后↑ |
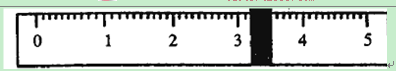
烧杯的质量为 g。
②称量烧杯和NaOH固体的质量。再在天平右盘上放置 g砝码,将游码的位置移到 g的位置,往烧杯中逐渐加入NaOH固体,直到天平达到平衡。
Ⅱ、乙同学欲用用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移
⑤洗涤 ⑥定容 ⑦摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (请填编号)(从下列中选用 A.10ml B.25ml C.50ml D.100ml)
(2)定容时俯视溶液的凹液面对所配制的稀硫酸浓度有何影响
(用偏大、偏小、无影响填写)