题目内容
3.当今世界,能源的发展日益成为全世界、全人类共同关心的问题.乙烷、二甲醚的燃烧热较大,可用作燃料,如图是乙烷、二甲醚燃烧过程中的能量变化图.请回答下列问题: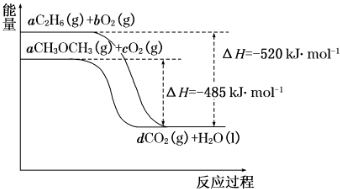
(1)等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物放出的热量少(填“多”或“少”)口
(2)乙烷的燃烧热△H=-1560kJ.mol-1
(3)写出二甲醚燃烧的热化学方程式:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455kJ•mol-1
(4)二氧化碳是重要的温室气体.从环保的角度分析,放出相同的热量时,选择乙烷(填“乙烷”或“二甲醚”)作为燃料产生的CO2较少.
分析 (1)依据液态乙烷转化为气态乙烷要吸热分析;
(2)依据原子守恒分析可知氢原子守恒,6a=2,a=$\frac{1}{3}$,则根据图象分析可知 $\frac{1}{3}$mol乙烷完全燃烧放热520KJ,所以1mol乙烷完全燃烧放热为520KJ×3=1560KJ;
(3)根据图象分析可知$\frac{1}{3}$mol二甲醚完全燃烧放热485KJ,结合热化学方程式书写方法标注物质聚集状态和对应反应的焓变写出;
(4)根据图象可知,消耗相同物质的量的乙烷和二甲醚生成的二氧化碳相同,但放出的热量乙烷多,据此分析.
解答 解:(1)因为液态乙烷转化为气态乙烷要吸热,所以等物质的量的液态乙烷比气态乙烷完全燃烧生成稳定的氧化物放出的热量少,故答案为:少;
(2)依据原子守恒分析可知氢原子守恒,6a=2,a=$\frac{1}{3}$,则根据图象分析可知 $\frac{1}{3}$mol乙烷完全燃烧放热520KJ,所以1mol乙烷完全燃烧放热为520KJ×3=1560KJ,则乙烷的燃烧热△H=-1560kJ.mol-1,故答案为:-1560;
(3)根据图象分析可知$\frac{1}{3}$mol二甲醚完全燃烧放热485KJ,则1mol二甲醚完全燃烧放热=485KJ×3=1455KJ,反应的热化学方程式为:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455 kJ•mol-1,
故答案为:CH3OCH3(g)+3O2(g)→2CO2(g)+3H2O(l)△H=-1455 kJ•mol-1;
(4)根据图象可知,消耗相同物质的量的乙烷和二甲醚生成的二氧化碳相同,但放出的热量乙烷多,所以放出相同的热量时,选择乙烷作为燃料产生的CO2较少,故答案为:乙烷.
点评 本题考查了热化学方程式书写方法,反应焓变的计算应用,图象分析判断,掌握基础是解题关键,题目较简单.

| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
Ⅰ.取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.下列推断不正确的是( )
| A. | 由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ | |
| B. | Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O | |
| C. | 原溶液一定只含有的离子I-、NO3-、SO42-、Mg2+、Al3+ | |
| D. | 另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)②③⑦三种元素的原子半径从大到小的顺序为Cl>N>O(填元素符号)
(3)在最高价氧化物的水化物中,酸性最强的化合物的化学式HClO4,碱性最强的化合物的名称氢氧化钾.
(4)元素⑤的氧化物与元素④的最高价氧化物对应水化物反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O.
(5)元素⑥和⑦形成的气态氢化物较稳定是HCl(填化学式),用方程式来说明元素⑦的非金属性比⑥的非金属强的事实Cl2+H2S=S↓+2HCl(一个或两个方程式均可)
(6)表示①与③形成的化合物的电子式
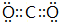 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等. | A. | CH4→CO2 | B. | KMnO4→K2MnO4 | C. | SO2→SO32- | D. | H2O2→O2 |
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | ||
| C. | (CH3)2CHCH2CH2CH(CH3)2 | D. | (CH3)2CHCH2CH3 |
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
| A. | 从1L 1 mol•L-1 的氯化钠溶液中取出10ml后,其浓度仍是1 mol•L-1 | |
| B. | NaHSO4溶液与NaOH溶液反应的离子方程式:H++OH-═H2O | |
| C. | 黄河入海口处三角洲的形成与胶体性质无关 | |
| D. | 氧化剂具有氧化性,在化学反应中化合价降低,发生还原反应 |
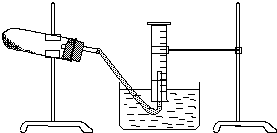 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下: