题目内容
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
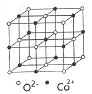
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 3 高于 H2O分子间可形成氢键,而H2S分子间无氢键 sp3 极性 6 八面体 5 12 ![]()
【解析】
(1)钴元素为第27号元素,根据构造原理,其基态原子核外的电子排布式为:1s22s22p63s23p63d74s2或[Ar]3d74s2;其3d轨道上有3个未成对电子,故未成对电子数为3;
(2)①H2O的沸点高于H2S,原因是H2O分子间可形成氢键,而H2S分子间无氢键;H2O的中心原子O的成键电子对数为2,未成对电子数为:![]() =2,故氧原子的杂化方式为sp3;H2O的空间结构为V型,其正负电荷中心不重叠,故属于极性分子;
=2,故氧原子的杂化方式为sp3;H2O的空间结构为V型,其正负电荷中心不重叠,故属于极性分子;
②在配合物[Co(NH3)4(H2O)2]Cl3中,配体为NH3、H2O,其配位数=4+2=6;其阳离子的成键电子对数为6,孤电子对数为0,故其立体构型为八面体;若[Co(NH3)4(H2O)2]Cl3其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的结构可通过下列方法解答:[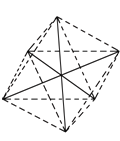 (正八面体构型)],两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体;
(正八面体构型)],两个NH3分子分别被Cl-和H2O取代,形成[Co(NH3)2Cl2(H2O)2]3+,六个顶点,有三种基团,设为ABC,第一类是相同基团以Co原子为对称中心,不考虑光学异构,只有一种;第二类,以第一种为原型上下顶点不变,只改变正方形,只有一种变化,即原来正方形中的相同基团相邻了,因为有三种基团,所以该类有三种几何异构体;第三类,所有相同的基团都相邻,不考虑光学异构,也只有一种异构体。综上所述,共有5种几何异构体;
(3)由CoO的晶胞结构可知,每个Co2+的周围与它最接近的且距离相等的Co2+共有12个;若晶体中Co2+与O2-的最小距离为acm,即该晶胞的边长为2acm,其体积为8a3cm3,该晶胞含有4个CoO“分子”,其质量为![]() g,其密度
g,其密度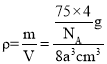 =
=![]() g/cm3。
g/cm3。

 阅读快车系列答案
阅读快车系列答案