题目内容
4.对于下列物质中制定元素化合价分析错误的是( )| A. | 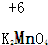 | B. | 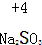 | C. | 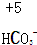 | D. | 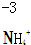 |
分析 设所求的元素的化合价为x,然后根据在化合物中化合价的代数和为0来计算,在离子中化合价的代数和等于离子的化合价,据此分析.
解答 解:A、设Mn元素的价态为x,则有:2+x-8=0,则x=+6,故A正确;
B、设硫元素的价态为x,则有:2+x-6=0,则x=+4,故B正确;
C、设碳元素的价态为x,则有:1+x-6=-1,则有x=+4,故C错误;
D、设N元素的价态为x,则有:x+4=-1,则x=-3,故D正确.
故选C.
点评 本题考查了在化合物和离子中元素化合价的计算,难度不大,属于基础性题目,注意方法的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列实验操作中正确合理的是( )
| A. | 用100 mL容量瓶配制50 mL 0.1 mol/L盐酸 | |
| B. | 在托盘天平上称量NaOH时,应将NaOH固体放在小烧杯中称量 | |
| C. | 用25 mL量筒量取4.0 mol/L的盐酸5.62 mL | |
| D. | 用托盘天平准确称取5.85 g NaCl固体 |
12.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,液态水的气化热为40.69 kJ•mol-1,则H2O(g)?H2O(l) 的△H=40.69 kJ•mol-1 | |||||||||||
| B. | 100mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA | |||||||||||
| C. | 已知:
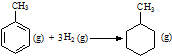 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液的pH减小 |
9.往含Fe3+、H+、NO3-的混合液中加入少量SO${\;}_{3}^{2-}$,充分反应后,下列表示该反应的离子方程式正确的是( )
| A. | 2Fe3++SO${\;}_{3}^{2-}$+H2O═2Fe2++SO${\;}_{4}^{2-}$+2H+ | |
| B. | 2H++SO${\;}_{3}^{2-}$═H2O+SO2↑ | |
| C. | 2H++2NO${\;}_{3}^{-}$+3SO${\;}_{3}^{2-}$═3SO${\;}_{4}^{2-}$+2NO↑+H2O | |
| D. | 2Fe3++3SO${\;}_{3}^{2-}$+3H2O═2Fe(OH)3↓+3SO2↑ |
14.下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
| A. | 取ag混合物充分加热,剩余bg固体 | |
| B. | 取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg | |
| C. | 取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得bg固体 | |
| D. | 取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得bg固体 |

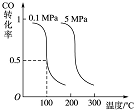 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积 为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇: