题目内容
【题目】已知常温下HClO的Ka=4.7×10-8,在c(H2SO3)+c(HSO![]() )+c(SO
)+c(SO![]() )=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
)=0.1mol·L-1的H2SO3和NaOH混合溶液中含硫微粒的物质的量分数ɑ随pH的变化曲线如图所示。下列叙述正确的是( )
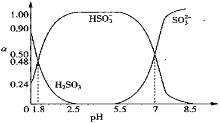
A.pH=7.2时,混合溶液中由水电离的c(H+)=10-7.2
B.等浓度的Na2SO3溶液pH比NaClO溶液的大
C.将等浓度、等体积的NaClO和Na2SO3溶液混合,混合液接近中性
D.Na2SO3溶液中:c(Na+)=2c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)
)+c(H2SO3)
【答案】C
【解析】
A. 从图中可知pH=7.2时,混合溶液中存在大量的SO![]() 和HSO
和HSO![]() ,现溶液呈弱碱性的,故水电离的c(H+) =水电离出的c(OH-)=溶液中的c(OH-)=
,现溶液呈弱碱性的,故水电离的c(H+) =水电离出的c(OH-)=溶液中的c(OH-)= ![]() ,故A错误;
,故A错误;
B. 从图中,PH=1.8和PH=7两点不难得出,H2SO3的Ka1=10-1.8、Ka2=10-7,由于H2SO3的Ka2=10-7大于HClO的Ka,根据越弱越水解的规律可知,等浓度的Na2SO3溶液pH比NaClO溶液的小,故B错误;
C. 将等浓度、等体积的NaClO和Na2SO3溶液混合,二者将发生氧化还原反应,NaClO + Na2SO3= NaCl + Na2SO4,故混合液接近中性,故C正确;
D. Na2SO3溶液的物料守恒式应该为:c(Na+)=2c(SO![]() )+2c(HSO
)+2c(HSO![]() )+2c(H2SO3),故D错误;
)+2c(H2SO3),故D错误;
本题答案为:C

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案
相关题目