题目内容
7.短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36.且原子最外层电子数之和为14;A与C,B与D分别为同主族;含有C元素的物质灼烧时火焰呈黄色.下列叙述正确的是( )| A. | A与B只能形成一种化合物 | |
| B. | B的离子半径小于C的离子半径 | |
| C. | D元素最高价氧化物的水化物显两性 | |
| D. | 由A、B、C形成的化合物既含离子键又含共价键 |
分析 短周期元素A、B、C、D的原子序数依次增大,B与D为同主族元素,则B与D分别位于第二、第三周期.含有C元素的物质灼烧时火焰呈黄色,则C为Na;A与C同主族,则A、C处于第ⅠA族,A、B、C、D的原子最外层电子数之和为14,则B、D的原子最外层电子数为$\frac{14-1×2}{2}$=6,所以B为氧元素,D为硫元素;A、B、C、D的原子序数之和为36,所以A、C的原子序数之和为36-8-16=12,所以A为氢元素,据此解答.
解答 解:短周期元素A、B、C、D的原子序数依次增大,B与D为同主族元素,则B与D分别位于第二、第三周期.含有C元素的物质灼烧时火焰呈黄色,则C为Na;A与C同主族,则A、C处于第ⅠA族,A、B、C、D的原子最外层电子数之和为14,则B、D的原子最外层电子数为$\frac{14-1×2}{2}$=6,所以B为氧元素,D为硫元素;A、B、C、D的原子序数之和为36,所以A、C的原子序数之和为36-8-16=12,所以A为氢元素.
A.A与B只能形成的化合物有:H2O和H2O2,故A错误;
B.O2-、Na+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+,故B错误;
C.D的最高价氧化物的水化物为硫酸,属于强酸,故C错误;
D.A、B、C三元素形成形成的化合物为NaOH,含有离子键、共价键,故D正确,
故选:D.
点评 本题考查原子结构与元素周期律,元素的推断是解答本题的关键,注意含C化合物焰色反应为推断突破口.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
2.有4种有机物:
①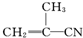 ②
②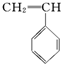 ③
③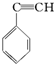 ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为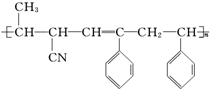 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )
①
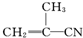 ②
② ③
③ ④CH3-CH═CH-CN,其中可用于合成结构简式为
④CH3-CH═CH-CN,其中可用于合成结构简式为 的高分子材料的正确的组合为( )
的高分子材料的正确的组合为( )| A. | ①③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
16.下列关于煤、石油、天然气等资源的说法正确的是( )
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 天然气是一种清洁的化石燃料 | |
| C. | 石油产品都可用于聚合反应 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 范德华力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 范德华力 | D. | 范德华力 氢键 非极性键 |
 ,推测苯分子中有两种不同的碳碳键,即碳碳单键和碳碳双键,因此它可以使紫色的高锰酸钾溶液褪色.
,推测苯分子中有两种不同的碳碳键,即碳碳单键和碳碳双键,因此它可以使紫色的高锰酸钾溶液褪色.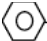 表示苯分子的结构更合理.
表示苯分子的结构更合理.
