题目内容
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
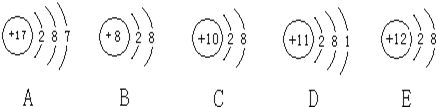
(1)属于离子结构示意图的是______、______(填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______,最容易失去电子的原子是______,最容易得到电子的原子是______。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______、______。
【答案】B E C D A NaCl=Na++Cl- Na+ Al3+
【解析】
质子数与核外电子数相等为原子,质子数与核外电子数不相等的为离子,金属元素的原子易失去电子,非金属元素的原子易得到电子;周期表中上周期右边的元素形成的离子与下周期左边的元素形成的离子具有相同的核外电子排布,据此解答。
根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。则
(1)结构示意图中质子数与核外电子数不相等的是离子,故答案为B、E;
(2)稀有气体元素最外层已达到稳定结构,性质最稳定;金属元素的原子易失去电子,非金属元素的原子易得到电子,5种粒子中D为Na,易失电子,A为Cl原子,则Cl原子最容易得电子,故答案为C、D、A;
(3)A、D两种元素形成的化合物为NaCl,NaCl在水溶液中电离出钠离子和氯离子,电离方程式为NaCl=Na++Cl-;
(4)最外层有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子,故答案为Na+、Al3+、F-等。

【题目】回答下列问题:
(1)在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___。
(2)1.00L 1.00mol/LH2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为___。
(3)已知反应CH3-CH3→CH2=CH2(g)+H2(g),有关化学键的键能如下:
化学键 | C-H | C=C | C-C | H-H |
键能E/kJ/mol | 414.4 | 615.3 | 347.4 | 435.3 |
通过计算得出该反应的反应热为_______________。
(4)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和H2O(g)时,放出33.4kJ的热量,则该反应的热化学方程式为________。