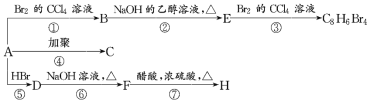
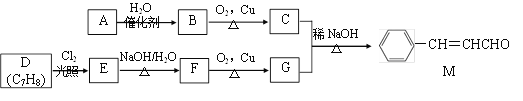
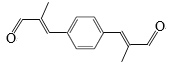
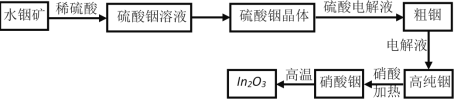
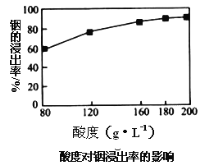
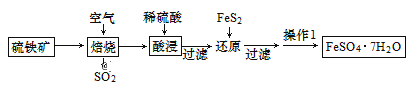
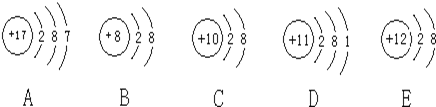
题目内容
【题目】一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应:NO2(g)+ SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到反应限度的是
SO3(g)+NO(g),下列能说明反应达到反应限度的是
A. 体系压强保持不变B. 混合气体颜色保持不变
C. SO3和NO的体积比保持不变D. 每消耗1 mol SO3的同时生成1 mol NO2
【答案】B
【解析】
A.反应前后气体的物质的量不变,恒温恒容下,压强始终不变,因此体系压强保持不变,不能说明反应达到反应限度,故A错误;
B.混合气体颜色保持不变,说明二氧化氮的浓度不变,能够说明反应达到反应限度,故B正确;
C.根据方程式,SO3和NO的体积比始终为1∶1保持不变,因此不能说明反应达到反应限度,故C错误;
D.每消耗1molSO3 的同时生成1molNO2,均表示逆反应速率,反应始终按该比例关系进行,不能说明反应达到反应限度,故D错误;
故选B。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因___________________________;
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
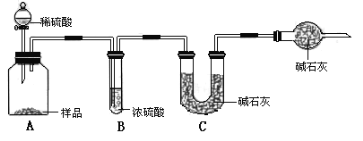
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl2+H2O+CO2↑)。完成三次实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
分析与 计算 分组 | 计算样品中碳酸钠 的质量分数 | 对实验结果 的评价 | 实验失败的主要原因 及对结果的影响 |
甲组 | _______________ | 失败 | ____________ |
乙组 | ____________ | 成功 | |
丙组 | ______________ | 成功 |