��Ŀ����
����Ŀ��25 ��ʱijЩ����ĵ���ƽ�ⳣ�����±���ʾ��
CH3COOH | HClO | H2CO3 |
K��CH3COOH�� ��1.8��10-5 | K��HClO�� ��3.0��10-8 | K��H2CO3��a1��4.4��10-7 K��H2CO3��a2��4.7��10-11 |
�����£�ϡ��CH3COOH��HClO������ʱ����Һ��pH���ˮ���仯��������ͼ��ʾ������˵����ȷ������ ��
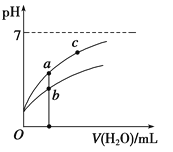
A����ͬŨ�ȵ�CH3COOH��HClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�
c��H+����c��ClO-����c��CH3COO-����c��OH-��
B��ͼ����a��c������������Һ��![]() �����HR����CH3COOH��HClO��
�����HR����CH3COOH��HClO��
C��ͼ����a�����Ũ�ȴ���b�����Ũ��
D����NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��2ClO����CO2��H2O��2HClO��CO32��
���𰸡�B
��������
���������A������ĵ��볣�����ڴ����ᣬ������ͬŨ�ȵ�CH3COOH��HClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��H+����c��CH3COO-����c��ClO-����c��OH-����A����B����![]() �ķ��ӡ���ĸͬʱ����������Ũ�ȿɵã�
�ķ��ӡ���ĸͬʱ����������Ũ�ȿɵã�![]() ���¶Ȳ��䣬��ñ�ֵ���䣬����ˮ�����ӻ��͵���ƽ�ⳣ��ֻ���¶�Ӱ�죬a��c���¶���ͬ����ñ�ֵ��ȣ�B��ȷ��C��pH��ȵ�CH3COOH��HClO��ϡ����ͬ�ı���ʱ����ǿ����������Ũ��С�ڽ����ᣬ��������pHС�ڽ�ǿ�ᣬ����CH3COOH��HClO������a�������߱�ʾCH3COOH��b�������߱�ʾHClO��������ĵ���̶�С�ڴ��ᣬ���Դ����Ũ�ȼ�С���������Ũ�Ƚϴ�a��b������ȣ�������ͬ�����ˮ����Ȼ�Ǵ������Ũ�Ƚϴ���ͼ����a�����Ũ��С��b�����Ũ�ȣ�C����D��̼��Ķ�������С�ڴ����ᣬ����̼��������ӵ�����С�ڴ����ᣬ����NaClO��Һ��ͨ������������̼�����ӷ���ʽ��ClO-+CO2+H2O�THClO+HCO3-��D������ѡB��
���¶Ȳ��䣬��ñ�ֵ���䣬����ˮ�����ӻ��͵���ƽ�ⳣ��ֻ���¶�Ӱ�죬a��c���¶���ͬ����ñ�ֵ��ȣ�B��ȷ��C��pH��ȵ�CH3COOH��HClO��ϡ����ͬ�ı���ʱ����ǿ����������Ũ��С�ڽ����ᣬ��������pHС�ڽ�ǿ�ᣬ����CH3COOH��HClO������a�������߱�ʾCH3COOH��b�������߱�ʾHClO��������ĵ���̶�С�ڴ��ᣬ���Դ����Ũ�ȼ�С���������Ũ�Ƚϴ�a��b������ȣ�������ͬ�����ˮ����Ȼ�Ǵ������Ũ�Ƚϴ���ͼ����a�����Ũ��С��b�����Ũ�ȣ�C����D��̼��Ķ�������С�ڴ����ᣬ����̼��������ӵ�����С�ڴ����ᣬ����NaClO��Һ��ͨ������������̼�����ӷ���ʽ��ClO-+CO2+H2O�THClO+HCO3-��D������ѡB��

 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�